-
下列对有关文献的理解错误的是( )
A. “所在山洋,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作。
B. 《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不没,“气”凝即得 “矾油”。青矾厂气是NO 和NO2。
C. 《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作时如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是醋酸亚铁。
D. 唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了黑火药制作过程。
难度: 简单查看答案及解析
-
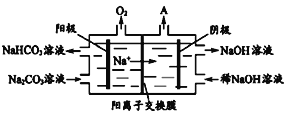
下列离子方程式书写正确的是
A. Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O32- + 6H+ =2S↓ +3H2O
B. 向饱和Na2CO3溶液中通入过量CO2,CO32-+CO2+H2O═2HCO3-
C. Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O
D. CuSO4与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molHClO中所含H—Cl键的数目为NA
B. 8.8g乙酸乙酯中所含碳原子数为0.4NA
C. 1.2gC与0.1molCO2在高温下充分反应生成的CO分子数为0.1NA
D. 标准状况下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中NH4+的数目为0.1NA
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.010mol·L-1氨水
用量筒量取10.0mL5.00mol·L-1氨水于烧杯中,加入少量蒸馏水稀释,转移至500 mL容量瓶中定容
B
探究SO2的还原性
向盛有2mLH2S溶液的试管中缓慢通入SO2,观察是否有沉淀生成
C
制取并纯化溴苯
向FeBr3固体中慢慢加入Br2的苯溶液,充分反应后经水洗、Na2SO3溶液洗、水洗、分液、干燥,然后蒸馏
D
比较两种黑色固体FeS和CuS的溶度积
向物质的量浓度相同的FeCl2和CuCl2的混合溶液中不断加入Na2S溶液,观察沉淀颜色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
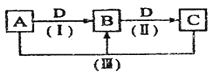
常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是
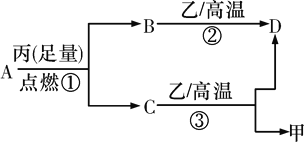
A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
难度: 困难查看答案及解析
-
抗结肠炎药物Y结构如图所示,以下说法错误的是
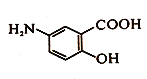
A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
难度: 困难查看答案及解析
-
已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)
 NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)难度: 中等查看答案及解析
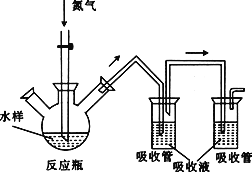
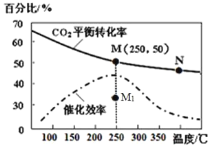
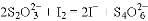 )
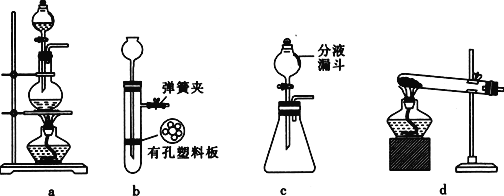
)
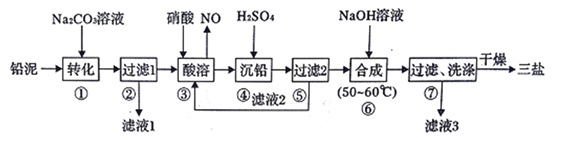
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1