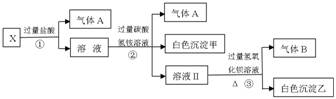
-
清蒸大闸蟹由青色变成红色,一同学认为这种红色物质可能象酸碱指示剂一样,遇到酸或碱颜色会发生改变。就这位同学的看法而言,这应该属于科学探究中的
A.实验 B.假设 C.观察 D.分类
难度: 简单查看答案及解析
-
下列有关氧化还原反应的叙述中正确的是
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,生成还原产物
难度: 简单查看答案及解析
-
下列实验现象的描述错误的是
A.氢气在氯气中燃烧生成白色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.红热的铜丝在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
难度: 简单查看答案及解析
-
下列关于胶体的叙述正确的是
A.胶体粒子不能透过滤纸
B.胶体和溶液的本质区别是胶体能发生丁达尔现象
C.胶体带电,故在电场作用下会产生电泳现象
D.用渗析的方法净化胶体时,使用半透膜只能让小分子和离子通过
难度: 简单查看答案及解析
-
下列说法都正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②蔗糖、硫酸钡和纯碱分别属于非电解质、弱电解质和强电解质
③用玻璃棒搅拌漏斗中的液体以加快过滤速度
④在容量瓶中加入一体积的水,再加入浓硫酸配制准确浓度的稀硫酸
⑤常用的自来水消毒剂有氯气和二氧化氯,氯气的消毒效率低于二氧化氯。
A.②③⑤ B.②④ C.①⑤ D.①④
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗数的值。下列叙述正确的是
A.H2O2中加入MnO2,当产生0.1 mol O2时转移电子数为0.4 NA
B.常温常压下,0.1mol氖气含有的电子数为NA
C.22.4 L Cl2与足量Fe反应,转移的电子数为2NA
D.反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成1 molCl2转移的电子为6NA
难度: 简单查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.石灰石与硫酸反应制CO2:CaCO3 + 2H+=Ca2+ + CO2↑ + H2O
B.Na2O2与H2O反应制备O2:Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.③⑤⑥ C.②④ D.②④⑥
难度: 简单查看答案及解析
-
等物质的量的过氧化钠与碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.NaOH Na2CO3
C.Na2O2 Na2CO3 D.Na2O2 NaOH Na2CO3
难度: 简单查看答案及解析
-
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入 AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为

A.V1/(V2-V1) B.V1/V2
C.(V2-V1)/V1 D.V2/V1
难度: 简单查看答案及解析
-
已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,下列反应在水溶液中不可能的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
V mL Al2(SO4)3溶液中含有Al3+ a g,取0.5V mL溶液稀释到8V mL,则稀释后溶液中SO42-的物质的量浓度是
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 简单查看答案及解析
-
用1 L 1.0 mol / L NaOH溶液吸收0.8 mol CO2,所得溶液中的
和
的浓度之比约是
A.1∶3 B.1∶2 C.2∶3 D.3∶2
难度: 简单查看答案及解析
-
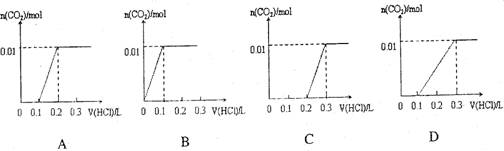
将0..4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
难度: 简单查看答案及解析
-
取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为
A.2:1:2 B.6:3:2 C.2:1:3 D.3:7:1
难度: 简单查看答案及解析