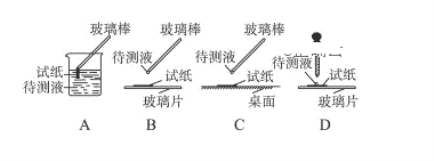
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:r(X) < r(Y) < r(Z) < r(W)
B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-) 逐渐减小
C. 放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
已知:①SO2+I2+2H2O═H2SO4+2HI;②向含有HCl、FeCl3和BaCl2的溶液中通入足量的SO2,产生白色沉淀;③将FeCl3溶液滴在淀粉-KI试纸上,试纸变蓝色。现有等物质的量的FeI2、NaHSO3的混合溶液100 mL,向其中通入4.48 L(标准状况)氯气,然后向反应后的溶液中滴加KSCN溶液,溶液呈微红色。下列有关说法正确的是( )
A. FeI2的物质的量浓度约为1 mol·L-1
B. 完全反应时转移电子0.2 mol
C. 通入氯气的过程中,首先被氧化的离子是Fe2+,最后被氧化的离子是I-
D. 反应后,溶液中大量存在的离子有Na+、H+、SO42-和Fe3+
难度: 中等查看答案及解析
-
化学与科技、医药、工业生产均密切相关。下列有关叙述正确的是( )
A. 2017年4月26日,中国第二艘航母举行下水仪式,该航母使用了素有“现代工业的骨骼”之称的碳纤维。碳纤维是一种新型的有机高分子材料
B. 硫酸铜溶液可用来浸泡蔬菜,以保持蔬菜的新鲜
C. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO2
D. 获得2015年诺贝尔生理学、医学奖的屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. NaHCO3受热易分解,可用于制胃酸中和剂
B. 铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板
C. Al2O3是两性氧化物,可用作耐高温材料
D. CaO能与水反应,可用作食品干燥剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2L乙醇中所含的氧原子数等于0.5NA
B. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
C. 18gH218O和2H2O的混合物中,所含中子数为9NA
D. 向100mL1mol/L Fe(NO3)3溶液中滴加足量的HI溶液,转移0.1 NA个电子
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣
A. ①② B. ②③ C. ②⑥ D. ②⑤⑥
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 酸性硫酸亚铁溶液在空气中被氧化:4Fe2++O2+4H+=4Fe3++2H2O
B. 硫酸铵溶液和氢氧化钡溶液反应: Ba2++SO42-= BaSO4↓
C. 碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3-+Ca2++2OH—= CaCO3↓+CO32-+2H2O
D. 酸化的NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. 中子数为20的氯原子:
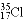 B. 二氧化硅的分子式:SiO2
B. 二氧化硅的分子式:SiO2C. 硫化氢的结构式:H—S—H D. 氯化铵的电子式:
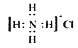
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 向蒸馏水中滴加浓硫酸时,Kw不变
B. 常温下,0.005mol·L-1 Ba(OH)2溶液的pH=12
C.
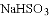 的电离方程式:
的电离方程式: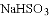

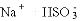
D. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
处于平衡状态的反应:2H2S(g)
 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下正确的是
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下正确的是A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正、逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
难度: 中等查看答案及解析
-
下列各组物质中,能一步实现下图所示①~⑤转化关系的是
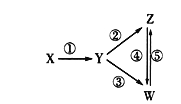
选项
X
Y
Z
W
A
CO2
C
Na2CO3
NaHCO3
B
Fe3O4
Fe
FeCl2
FeCl3
C
Al
Al2O3
NaAlO2
Al(OH)3
D
H2SO4
SO2
S
SO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
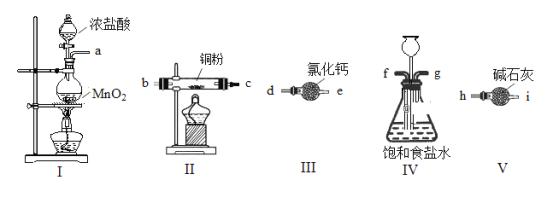
用下列实验装置进行相应实验,装置合理且能达到实验目的的是
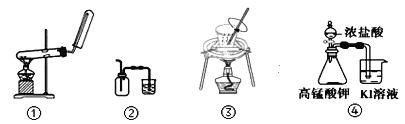
A. 装置①:用氯化铵和氢氧化钙制NH3 B. 装置②:收集NO气体
C. 装置③:从饱和食盐水中提取氯化钠 D. 装置④:探究氧化性:KMnO4>Cl2>I2
难度: 中等查看答案及解析
-
某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
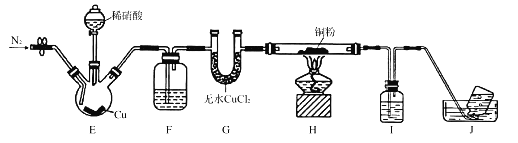
已知:在溶液中.FeSO4+NO
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是A. 装置B、E中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置D中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先关闭分液漏斗的活塞,再熄灭酒精灯
D. 装置F收集的气体中可能含有NO
难度: 中等查看答案及解析
-
反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在700℃时平衡常数为1.47,在900℃时平衡常数为2.15,下列说法正确的是( )
FeO(s)+CO(g)在700℃时平衡常数为1.47,在900℃时平衡常数为2.15,下列说法正确的是( )A. 升高温度,该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为
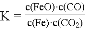
C. 该反应的正反应是吸热反应
D. 增大CO2浓度,平衡常数增大
难度: 中等查看答案及解析
-
下图曲线a表示放热反应 X(g) + Y(g)
 Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s) △H <0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是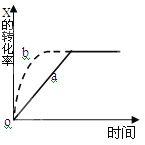
A. 升高温度 B. 加大X的投入量
C. 加催化剂 D. 增大体积
难度: 简单查看答案及解析

 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示: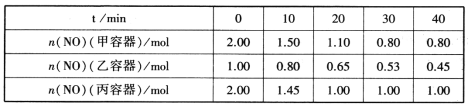
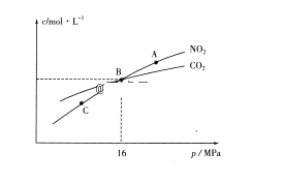
 2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表: