-
下列各组中的性质比较正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:KOH>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:F->Cl->Br- ⑤熔点:Li<Na<K<Rb<Cs
A. ①③⑤ B. ②③④ C. ①②③ D. ③④⑤
难度: 中等查看答案及解析
-
不可能是乙烯加成产物的是
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
难度: 简单查看答案及解析
-
下列四种酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A.10℃20mL3mol/L的盐酸溶液 B.20℃30mL3mol/L的盐酸溶液
C.20℃20mL4mol/L的醋酸溶液 D.20℃10mL2mol/L的硫酸溶液
难度: 中等查看答案及解析
-
下列指定微粒的个数比为2:1的是 ( )
A.Be2+中的质子和电子 B.21H原子中的中子和质子
C.NaHCO3中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子
难度: 简单查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子构成HmX分子。在agHmX中所含质子的物质的量是( )
A.
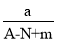 mol B.
mol B.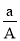 (A-N)mol
(A-N)molC.
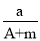 (A-N)mol D.
(A-N)mol D.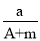 (A-N+m)mol
(A-N+m)mol难度: 简单查看答案及解析
-
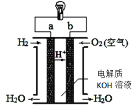
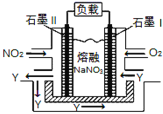
锂(Li)—空气电池的工作原理如图所示下列说法不正确的是( )
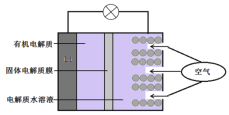
A.金属锂作负极,发生氧化反应
B.正极的电极反应:O2+4e-=2O2-
C.Li+通过有机电解质向水溶液处移动
D.电池总反应:4Li+O2+2H2O=4LiOH
难度: 中等查看答案及解析
-
被誉为“矿石熊猫”的香花石,是由我国地质学家首次发现,它由前20号元素中的6种主族元素组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同一主族,Y、Z、R、T位于同一周期,R元素原子的最外层电子数是次外层电子数的3倍,T无正价,X与R的原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应水化物的碱性:X>Z
D.XR2、WR2两种化合物中R的化合价相同
难度: 简单查看答案及解析
-
对可逆反应 4NH3(g)+5O2(g)
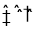 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成 n mol NO 的同时,消耗 n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
难度: 简单查看答案及解析
-
对于苯乙烯(
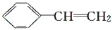 )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于苯但难溶于水;④密度比水小;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面。其中正确的是( )
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于苯但难溶于水;④密度比水小;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面。其中正确的是( )A.①②③④⑤ B.①②④⑤⑥ C.①②⑤⑥ D.全部正确
难度: 中等查看答案及解析
-
已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,下列关系式中正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2<2Q3
难度: 简单查看答案及解析
-
根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)
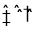 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1②I2(s)+H2((g)
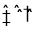 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1下列判断正确的是
A.254gI(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的生成物比反应②的生成物稳定
难度: 简单查看答案及解析
-
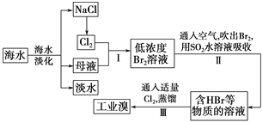
海水开发利用的部分过程如图所示。下列说法错误的是
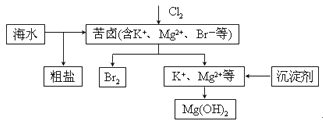
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
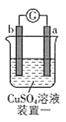
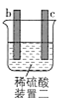
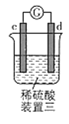
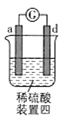
部分实验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.
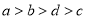 B.
B.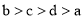 C.
C.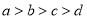 D.
D.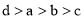
难度: 中等查看答案及解析
-
一种气态烷烃和一种气态烯烃组成的混合物共3.12g,混合气体的密度是相同状况下氢气密度的12倍,该混合物气体通过溴水时,溴水的质量增加1.68 g,则该混合气体是( )
A.甲烷、乙烯 B.甲烷、丙烯
C.乙烷、丙烯 D.丙烷、乙烯
难度: 困难查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为
 。下列说法正确的是
。下列说法正确的是A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷(C4H10)气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,其在熔融状态下能传导O2-。已知电池的总反应是2C4H10+13O2→8CO2+10H2O。下列说法不正确的是
A.在熔融电解质中,O2-向负极移动
B.通入丁烷的一极是负极,电极反应为C4H10+13O2--26e-=4CO2+5H2O
C.通入空气的一极是正极,电极反应为O2+2H2O+4e-=4OH-
D.燃料电池是一种高效、环境友好的发电装置
难度: 中等查看答案及解析
 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。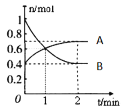
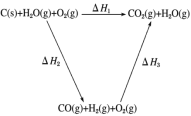
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为