-
下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液
溶液变红
稀硫酸能氧化Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O能大量共存
D
向10 mL 0.1 mol·L-1 Na2S溶液中滴入2 mL 0.1 mol·L-1 ZnSO4溶液,再加入2 mL 0.1 mol·L-1 CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是电子层数的3倍,Z的焰色反应呈黄色。常温下,Z和W形成化合物的水溶液的pH=7。下列说法正确的是( )
A.X与W属于不同周期、不同主族元素
B.简单离子半径:X<Z
C.简单氢化物的沸点:Y>W>Z
D.Z和W形成的化合物的水溶液与Y单质反应,能置换出W
难度: 简单查看答案及解析
-
下列有关化学用语正确的是
A.
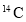 的原子结构示意图:
的原子结构示意图: B.
B.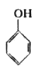 与
与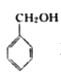 互为同系物
互为同系物C.过氧化钠的电子式是
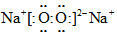 D.硝酸酐的化学式为
D.硝酸酐的化学式为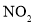
难度: 简单查看答案及解析
-
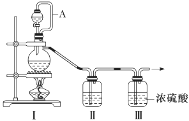
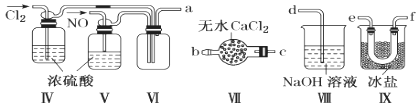
用下列实验装置进行相应的实验,能达到实验目的的是
A.
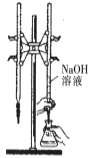 所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验B.
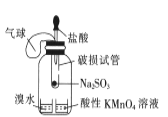 所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性C.
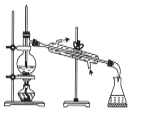 所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物D.
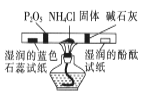 所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A.
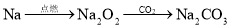
B.
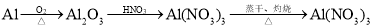
C.
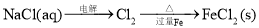
D.
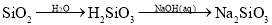
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.若将lmol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
B.lmolCH3COONa和少量CH3COOH溶于水所得中性溶液中,CH3COO-的数目为NA
C.标准状态下,2.24LC12溶于水,转移的电子数目为0.1NA
D.标准状况下,11.2L三氯甲烷所含的原子数为2NA
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
选项
实验目的
实验操作
A
除去蛋白质溶液中混有的(NH4)2SO4
将混合物装入半透膜袋,并放入流动的蒸馏水中
B
除去Mg 粉中混有的Al 粉
加入足量的NaOH 溶液,过滤、洗涤、干燥
C
用CCl4 萃取碘水中的I2
先从分液漏斗下口放出有机层,再从上口倒出水层
D
检验溶液中存在SO42‾
向未知溶液中加入盐酸酸化的BaCl2溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.
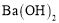 溶液中滴入
溶液中滴入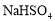 溶液至
溶液至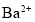 恰好完全沉淀:
恰好完全沉淀: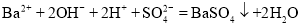
B.
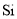 与
与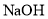 溶液反应:
溶液反应: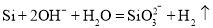
C.电解
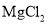 溶液:
溶液: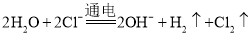
D.向氨水中通入过量
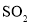 :
: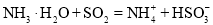
难度: 中等查看答案及解析
-
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是
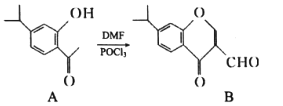
A.分子A中至少有8个碳原子位于同一平面
B.
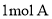 与浓溴水发生取代反应时,最多消耗
与浓溴水发生取代反应时,最多消耗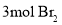
C.物质B能发生银镜反应,也能发生水解反应
D.
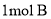 最多可与
最多可与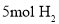 发生加成反应
发生加成反应难度: 中等查看答案及解析
-
下列说法不正确的是
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
 Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液难度: 简单查看答案及解析
-
下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
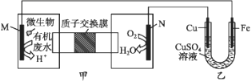
A.甲中H+透过质子交换膜由左向右移动
B.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-
 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+C.一段时间后,乙中CuSO4溶液浓度基本保持不变
D.当N极消耗0.25 mol O2时,则铁极增重16 g
难度: 中等查看答案及解析
-
下列关于有机物的说法不正确的是
A.糖类、油脂、蛋白质都能发生水解反应
B.酸性
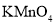 溶液可以鉴别苯、乙醇和乙酸
溶液可以鉴别苯、乙醇和乙酸C.苯和乙烯均可以使溴水褪色,但褪色原理不同
D.分子式为
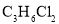 的同分异构体共有4种(不考虑立体异构)
的同分异构体共有4种(不考虑立体异构)难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.向
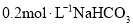 溶液中加入等体积
溶液中加入等体积 溶液:
溶液: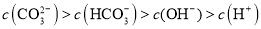
B.物质的量浓度都为
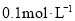 的
的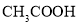 与
与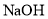 溶液等体积混合后,
溶液等体积混合后,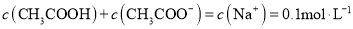
C.已知常温下,
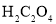 的电离常数
的电离常数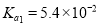 ,
,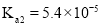 .
.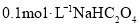 溶液:
溶液: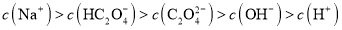
D.
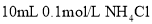 溶液与
溶液与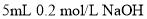 溶液混合:
溶液混合: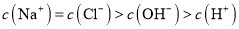
难度: 困难查看答案及解析
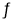 CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1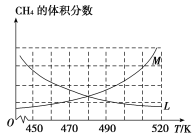

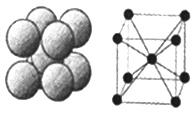
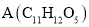 同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只2种;③
同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只2种;③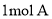 与足量的
与足量的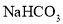 反应生成
反应生成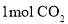 ;④遇
;④遇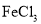 溶液不显色.A如图所示转化关系:
溶液不显色.A如图所示转化关系:

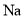 反应产生
反应产生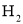 ,共有_____种(不含立体异构).其中核磁共振氡谱显示为3组峰,且峰面积比为6:1:1的是_________(写结构简式).
,共有_____种(不含立体异构).其中核磁共振氡谱显示为3组峰,且峰面积比为6:1:1的是_________(写结构简式).