-
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是
A. 1.12L H2 B. 1.12L O2 C. 2.24L H2 D. 2.24L O2
难度: 简单查看答案及解析
-
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是
A.PH3分子的P-H键是非极性键
B.PH3比NH3稳定
C.PH3的分子构型是正四面体形
D.PH3分子中有未成键的孤对电子
难度: 中等查看答案及解析
-
下列电极反应式与出现的环境相匹配的是( )
选项
电极反应式
出现的环境
A
O2+4H++4e-=2H2O
酸性环境下氢氧燃料电池的负极反应
B
4OH--4e-=O2↑+2H2O
弱酸性环境下钢铁的吸氧腐蚀
C
Cu-2e-=Cu2+
用铜做电极电解硫酸铜溶液的阳极反应
D
Na++e-=Na
用惰性电极电解Na2SO4溶液的阴极反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。下列说法正确的是
A.医学上常采用碳酸钡作为钡餐
B.钢铁析氢腐蚀和吸氧腐蚀的速率一样快
C.“84消毒液”和75%的酒精杀菌清毒原理相同
D.泡沫灭火剂利用了硫酸铝溶液与碳酸氢钠溶液混合后能相互促进水解反应
难度: 简单查看答案及解析
-
下列物质中,既含有离子键又含有共价键的是
A.氢氧化钠 B.硫化钠 C.水 D.氯气
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.钾离子的电子排布式:[Ar]4s1
B.基态氮原子的电子排布图:
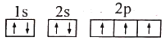
C.水的电子式:
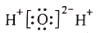
D.基态铬原子(24Cr) 的价电子排布式: 3d44s2
难度: 中等查看答案及解析
-
电解质电离时一定相等的是( )
A.阴离子与阳离子的总数 B.阳离子和阴离子的质量
C.正电荷总数和负电荷总数 D.每个阳离子和阴离子所带电荷数
难度: 中等查看答案及解析
-
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中
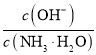 增大
增大难度: 中等查看答案及解析
-
现有下列四个图像:
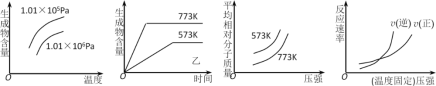
下列反应中全部符合上述图像的反应是 ( )
A.N2(g)+3H2(g)
 2NH3(g) ΔH1<0
2NH3(g) ΔH1<0B.2SO3(g)
 2SO2(g)+O2(g) ΔH2>0
2SO2(g)+O2(g) ΔH2>0C.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH3<0
4NO(g)+6H2O(g) ΔH3<0D.H2(g)+ CO(g)
 C(s)+H2O(g) ΔH4>0
C(s)+H2O(g) ΔH4>0难度: 中等查看答案及解析
-
在体积固定的密闭容器中发生反应:2CO(g)+ 4H2 (g)⇌CH3CH2OH(g)+H2O(g)。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.体系的压强不变
B.反应体系中乙醇的物质的量浓度不再变化
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
难度: 中等查看答案及解析
-
下列各组元素属于P区的是( )
A.原子序数为1、2、7的元素 B.
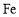 、
、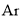 、Cl
、ClC.O、S、P D.Na、Li、Mg
难度: 简单查看答案及解析
-
下列原子的价电子排布中,对应元素第一电离能最大的是
A.ns2np1 B.ns2np2 C.ns2np3 D.ns2np4
难度: 简单查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2表示,单位为kJ·mol-1)
I1
I2
I3
I4
…
R
740
1500
7700
10500
…
下列关于元素R的判断中一定正确的是
A.R元素的原子最外层共有4个电子 B.R的最高正价为+3价
C.R元素位于元素周期表中第ⅡA族 D.R元素基态原子的电子排布式为1s22s2
难度: 中等查看答案及解析
-
下列溶液中离子浓度关系表示正确的是
A.NaHCO3 溶液中:c (H+)+c(Na+)=c(OH-) +c (
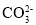 )+c(
)+c(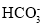 )
)B.常温下,pH=3 的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c (H+)> c(OH-)
C.0.1 mol/L的NH4Cl溶液中,c (Cl-)>c (H+)>c(
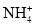 ) >c(OH-)
) >c(OH-)D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:c(Na+) =2[c(CH3OOH) +c(CH3COO-) ]
难度: 中等查看答案及解析
-
下列几组微粒互为等电子体的是
①
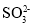 和
和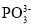 ;②NO+和 CN-;③CO2和 CS2;④NO2 和CO2
;②NO+和 CN-;③CO2和 CS2;④NO2 和CO2A.仅①②③ B.仅②④ C.仅①③④ D.①②③④
难度: 中等查看答案及解析
-
某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数
待测氢氧化钠溶液的体积/mL
0.1000 mol/L盐酸的体积/mL
滴定前刻度
滴定后刻度
第一次
25.00
0.00
27.45
第二次
25.00
0.00
30.30
第三次
25.00
0.00
17.55
下列说法正确的是
A.该氢氧化钠溶液中c(NaOH)=0.1155mol/L
B.当溶液从无色刚好变成红色时,则达到滴定终点
C.达滴定终点时,滴定管尖嘴有悬液,则测定结果偏低
D.实验中锥形瓶应用待测氢氧化钠溶液润洗
难度: 简单查看答案及解析
-
下列中心原子采取sp2杂化且为非极性分子的是
A.CS2 B.H2S C.SO2 D.SO3
难度: 中等查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A.
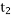 时加入了催化剂 B.
时加入了催化剂 B. 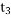 时降低了温度
时降低了温度C.
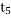 时增大了压强 D.
时增大了压强 D. 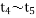 时间内转化率最高
时间内转化率最高难度: 中等查看答案及解析
-
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法中不正确的是( )
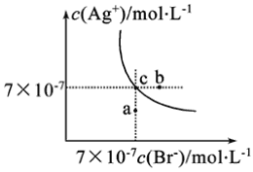
A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)
 AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816难度: 中等查看答案及解析
-
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)
 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )A.x=1 B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1 D.B的平均反应速率为0.2 mol·L-1·s-1
难度: 中等查看答案及解析
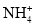 、H2O、 HBr中,含有配位键的微粒有_____,含有非极性键的微粒有________; 空间构型是三角锥形的分子_______。
、H2O、 HBr中,含有配位键的微粒有_____,含有非极性键的微粒有________; 空间构型是三角锥形的分子_______。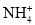 浓度的大小关系是: c (CH3COO-)_______ c(
浓度的大小关系是: c (CH3COO-)_______ c(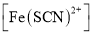 =0.68 mol/L。回答下列问题:
=0.68 mol/L。回答下列问题: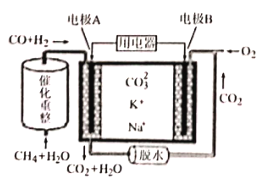
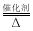 3H2+CO,当有2 mol CH4参加该反应,则转移____mol电子。
3H2+CO,当有2 mol CH4参加该反应,则转移____mol电子。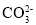 向电极____(填“A” 或”B”)移动。
向电极____(填“A” 或”B”)移动。
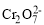 与黄色的
与黄色的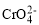 有下列平衡关系:
有下列平衡关系: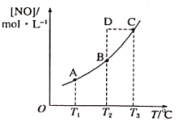
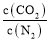 的值是_______。
的值是_______。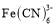 中含有σ键的数目为_____ (已知 CN-与N2是等电子体) ;Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe (CO)5晶体属于______(填晶体类型)。
中含有σ键的数目为_____ (已知 CN-与N2是等电子体) ;Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe (CO)5晶体属于______(填晶体类型)。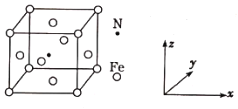
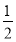 ,
,