-
中国科研提供抗疫“硬核力量”,在对新冠病毒的认识与防控中,化学知识起到了重要作用。下列说法不正确的是( )
A.新冠病毒DNA分子内存在氢键,氢键具有一定的方向性和饱和性
B.聚丙烯是生产医用口罩熔喷布的主要原料,其单体分子中碳原子均以sp2杂化
C.为了防止蛋白质变性,病毒疫苗一般需要冷藏存放
D.在选用酒精消毒时,75%的酒精溶液比95%的杀菌效果好
难度: 简单查看答案及解析
-
我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。下列说法不正确的是
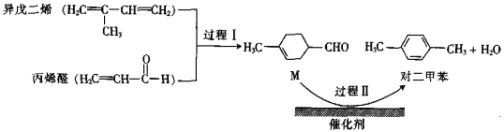
A.异戊二烯所有碳原子可能共平面
B.可用溴水鉴别M和对二甲苯
C.丙烯醛和M互为同系物
D.对二甲苯的一氯代物有2种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.52g苯乙烯含碳碳双键数目为2NA
B.标准状况下,22.4L一氯甲烷含共用电子对数为4NA
C.1L0.5mol·L-1醋酸钠溶液中阴阳离子总数目小于NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
难度: 中等查看答案及解析
-
近日,我国科研团队制备了基于稀土单原子催化剂(SAC)用于常温常压下的电化学催化还原氮气的反应。反应历程与能量关系如图所示(*表示稀土单原子催化剂)。
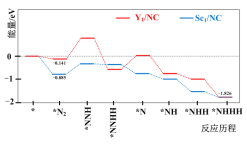
下列说法错误的是
A.Sc1/NC比Y1/NC更有利于吸附N2
B.该单原子催化电化学还原N2的反应∆H<0
C.使用Sc1/NC单原子催化剂时,历程中最大能垒的反应为:*N2+H→*NNH
D.使用Sc1/NC和Y1/NC催化电化学还原N2的反应∆H的值不相等
难度: 中等查看答案及解析
-
下述实验方案能达到实验目的的是 ( )
编号
A
B
C
D
实验
方案

食盐水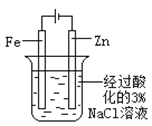
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液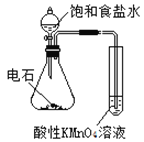
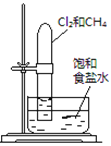
置于光亮处实验
目的验证铁钉发生
析氢腐蚀验证Fe电极被保护
验证乙炔的还原性
验证甲烷与氯气发生
化学反应A.A B.B C.C D.D
难度: 中等查看答案及解析
-
科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
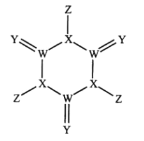
A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
难度: 中等查看答案及解析
-
向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中
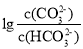 与
与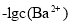 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是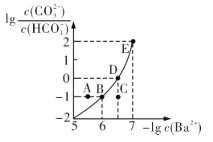
A.该溶液中
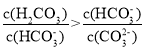
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
难度: 困难查看答案及解析
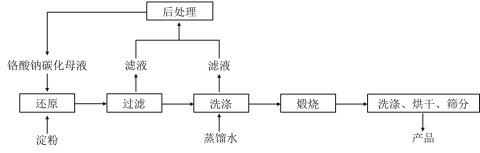
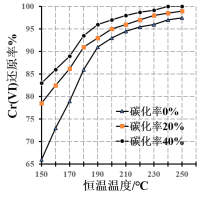
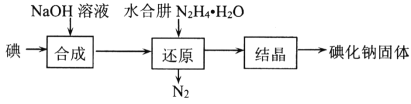
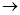 N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1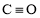
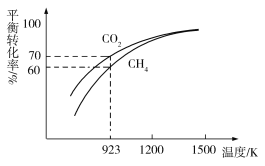
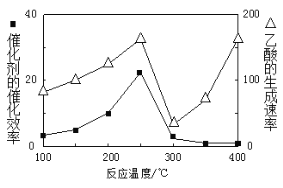
 CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下: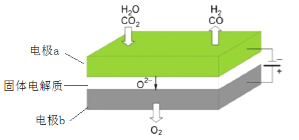
 )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为_______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为______________。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为_______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为______________。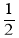 ,0,
,0,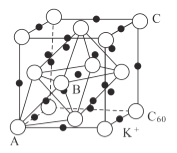
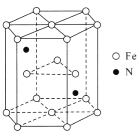
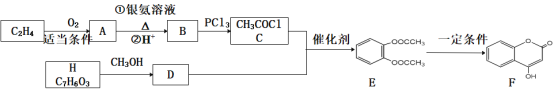
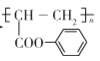 ),写出合成路线图(无机试剂自选)___。
),写出合成路线图(无机试剂自选)___。