-
下列各组变化中,化学反应的ΔH前者小于后者的一组是 ( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1;
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2;
②S(s)+O2(g)=SO2(g) ΔH1;
S(g)+O2(g)=SO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH1;
H2(g)+O2(g)=H2O(l) ΔH2;
④CaCO3(s)=CaO(s)+CO2(g) ΔH1;
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A. ①② B. ②③
C. ①③ D. ③④
难度: 中等查看答案及解析
-
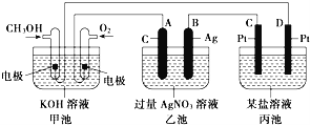
用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是 ( )
A. AgNO3[AgNO3] B. NaOH [NaOH]
C. KCl [KCl] D. CuSO4 [CuCO3]
难度: 困难查看答案及解析
-
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是 ( )
A. 负极反应为14H2O+7O2+28e-====28OH-
B. 放电一段时间后,负极周围的酸性减弱
C. 每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D. 放电过程中KOH的物质的量浓度不变
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是 ( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极保护法
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 纯银器表面在空气中因电化学腐蚀渐渐变暗
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 凡是放热反应都是自发的,由于吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
难度: 中等查看答案及解析
-
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2 (g)。
下列结论不能说明上述反应在该条件下已经达到平衡状态的是 ( )
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等 ③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化 ⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深 ⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A. ②③⑤⑥⑦ B. ①④⑧ C. ④⑥⑦ D. 只有②⑤
难度: 困难查看答案及解析
-
将氯酸钾加热分解,在0.5min内放出氧气5mL,加入二氧化锰后,在同样温度下0.2min内放出氧气50 mL,加入二氧化锰后反应速率是未加二氧化锰时反应速率的多少倍( )
A. 10 B. 25 C. 50 D. 250
难度: 简单查看答案及解析
-
在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是

A. 图I是加入适当催化剂的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
难度: 中等查看答案及解析
-
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF
由此可判断下列叙述不正确的是 ( )
A. K(HF)=7.2×10-4 B. K(HNO2)=4.6×10-4
C. 根据其中任意两个反应即可得出结论 D. K(HCN)<K(HNO2)<K(HF)
难度: 中等查看答案及解析
-
在蒸发皿中加热蒸干下列物质的溶液并灼烧,可得原有物质的固体是()
A. 氯化铝 B. 碳酸氢钠
C. 硫酸铁 D. 亚硫酸钠
难度: 困难查看答案及解析
-
用水稀释0.1mol·L-1氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/ c(OH-)
C. c(H+)和c(OH-)的乘积 D. OH-的物质的量
难度: 中等查看答案及解析
-
现有物质的量浓度相同的5种溶液:(a)NaHSO4,(b)NaHCO3;(c)H2SO4 (d)Al2(SO4)3;(e)Na2CO3,其pH由小到大的顺序为 ( )
A. (c)(a)(b)(d)(e) B. (c)(a)(d) (b)(e)
C. (e)(b)(d)(a)(c) D. (c)(a)(d)(e)(b)
难度: 困难查看答案及解析
-
一定条件下:甲分子和乙分子反应生成丙分子和丁分子,下列说法不正确的是( )

A. 分离甲和丙可以采用蒸馏法 B. 甲的空间构型是平面正六边形
C. 丙不属于烃类物质 D. 该反应类型是置换反应
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 芳香烃(即含苯环的烃)的获取主要来自煤的干馏和对石油分馏产品的催化重整
B. 正丁烷转化为异丁烷一定有能量变化
C. 石油的催化裂化主要目的是提高轻质液体燃料的产量尤其是汽油的产量
D. 石油的催化裂解是为了能得到润滑油、石蜡等
难度: 中等查看答案及解析
-
下列反应中前者属于取代反应,后者属于加成反应的是( )
A. 苯滴入浓硝酸和浓硫酸的混合液中加热;乙烯与水蒸汽在一定条件下生成乙醇
B. 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
C. 在苯中滴入溴水,溴水褪色; 乙烯使溴水褪色
D. 光照甲烷与氯气的混和物;乙烯使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
SCl6是一种无色的很稳定的物质,可用于灭火。SCl6的分子结构如图所示,呈正八面体型。如果氯原子被氢原子取代,则SCl6的氢取代物的分子种数为( )

A. 6 B. 9 C. 10 D. 12
难度: 困难查看答案及解析