-
下列有关化学用语使用正确的是( )
A.乙烯的结构简式:CH2CH2
B.乙烷的比例模型:
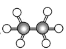
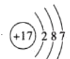
C.35Cl和37Cl的原子结构示意图:
D.过氧化氢的电子式:
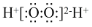
难度: 简单查看答案及解析
-
化学与生产、生活息息相关。下列说法正确的是( )
A.石油通过裂解可获得更多的轻质油,特别是汽油
B.生石灰、硅胶、P2O5等均可作食品干燥剂
C.聚乙烯和聚氯乙烯都是食品级塑料制品的主要成分
D.水果运输中常用浸泡过酸性高锰酸钾溶液的硅藻土保鲜水果
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.14 g分子式为CnH2n的烃中含有的C-H键的数目为2 NA
B.密闭容器中,0.1 mol N2和0.3 mol H2 催化反应后分子总数为0.2 NA
C.标准状况下,6.72 L三氯甲烷中含分子数为0.3 NA
D.1 mol Fe粉与足量碘蒸气反应,转移电子数为3 NA
难度: 简单查看答案及解析
-
室温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.加入了少量Na2O2的水溶液中:H+、Fe2+、Cl-、SO
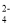
B.某无色酸性溶液中:Fe3+、NO
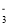 、Ba2+、H+
、Ba2+、H+C.加入Al能放出H2的溶液中:Cl-、NO
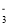 、SO
、SO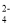 、NH
、NH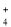
D.通入足量CO2的溶液中:H+、NH
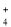 、Al3+、SO
、Al3+、SO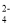
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.少量Cl2通入澄清石灰水中:Cl2+2OH- =ClO-+Cl-+H2O
B.向FeCl3溶液中加入Cu:2Fe3++3Cu=2Fe + 3Cu2+
C.室温下用稀HNO3溶解铜:Cu+2NO
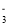 +2H+=Cu2++2NO2↑+H2O
+2H+=Cu2++2NO2↑+H2OD.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至Al3+完全沉淀:Al3++3OH-+2Ba2++2SO
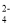 = Al(OH)3↓+BaSO4↓
= Al(OH)3↓+BaSO4↓难度: 中等查看答案及解析
-
某原电池的装置如图所示,总反应为H2(g)+HgO(s)=H2O(l)+Hg(l),其中交换膜只允许阴离子和水分子通过。下列说法正确的是( )
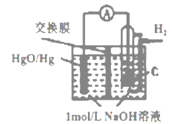
A.正极反应为:HgO−2e−+H2O=Hg+2OH−
B.放电结束后,溶液的碱性不变
C.标准状况下,每反应 2.24 L氢气,交换膜通过 0.2 mol 离子
D.OH−通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
难度: 简单查看答案及解析
-
下列化工生产原理、用途错误的是( )
①可以用电解熔融氯化钠的方法来制取钠
②黄铜矿(CuFeS2)冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
③可用铝热反应在野外焊接钢轨
④炼铁高炉中所发生的反应都是放热的,故无需加热
⑤制取粗硅的反应:SiO2+C
 Si+CO2↑
Si+CO2↑⑥工业上冶炼Ag:2Al+3Ag2O
 6Ag+Al2O3
6Ag+Al2O3A.①③⑥ B.④⑤⑥ C.②③⑤ D.②④⑥
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.1mol乙烷发生取代反应最多消耗3 mol Cl2
B.CH≡CH与HCl一定条件下发生反应,最多可生成3种产物
C.等物质的量的CH≡CH与苯(C6H6)完全燃烧生成CO2的量相等
D.乙烯分别通入溴水和溴的四氯化碳溶液中,反应现象完全相同
难度: 简单查看答案及解析
-
下列实验操作中,对应的现象及结论都正确且两者具有因果关系的是 ( )
选项
实验操作
实验现象
实验结论
A
将乙烯分别通入高锰酸钾酸性溶液和溴的四氯化碳溶液中
二者均褪色
二者褪色原理相同
B
甲烷与氯气在光照下反应后将其生成物通入紫色石蕊试液中
紫色石蕊试液变红
生成的甲烷氯代物具有酸性
C
将红热的木炭与少量浓HNO3反应
产生红棕色气体
木炭一定与浓硝酸发生了反应
D
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液后无明显现象
铁粉将Fe3+还原为Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。X的单质经常作为保护气,这四种元素可以组成阴阳离子个数比是1:1的离子化合物甲,由Y、Z形成的一种化合物乙和W、Z 形成的化合物丙反应生成淡黄色固体。下列说法中错误的是( )
A.化合物甲一定能与NaOH溶液反应
B.原子半径大小顺序是Z>X>Y>W
C.W、X组成的化合物X2W4中含有非极性键
D.W、X、Y组成的化合物水溶液一定呈酸性
难度: 中等查看答案及解析
-
下列关于有机化合物
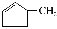 和
和 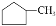 的说法正确的是( )
的说法正确的是( )A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D.
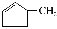 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上难度: 中等查看答案及解析
-
已知某烃混合物完全燃烧后,生成CO2和H2O的物质的量之比为l:1,该混合物不可能是
A.乙烯和丙烯(C3H6) B.乙烷和苯 C.甲烷和乙烷 D.苯和甲烷
难度: 困难查看答案及解析
-
下列关于同分异构体的说法正确的是
A.分子式为C3H6BrCl的有机物共4种(不考虑立体异构)
B.戊烷有三种同分异构体,其中新戊烷的沸点最低
C.CH3CH=CH2存在顺反异构
D.
 的一氯代物有4种
的一氯代物有4种难度: 中等查看答案及解析
-
一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀
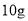 ,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是( )
,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是( )A.C2H6 B.C2H4 C.C3H4 D.C4H10
难度: 中等查看答案及解析
-
烯烃与酸性高锰酸钾溶液反应的氧化产物有如下表的对应关系:
烯烃被氧化的部位
CH2=
RCH=
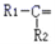
氧化产物
CO2
RCOOH
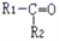
由此推断分子式为C4H8的烯烃被酸性KMnO4 溶液氧化后不可能得到的产物是( )
A.HCOOH和CH3CH2COOH B.CO2 和
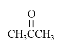
C.CO2 和CH3CH2COOH D.CH3COOH
难度: 简单查看答案及解析
-
某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1 mol·L-1。现进行如下实验(所加试剂均过量):
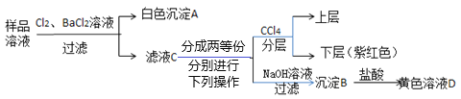
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、I−、SO42−
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1 L黄色溶液D能恰好溶解铁1.4 g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
难度: 困难查看答案及解析
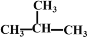 ⑤CH3CH=CH2 ⑥
⑤CH3CH=CH2 ⑥ 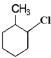
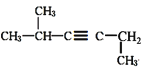 __________;
__________;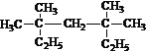 _____________;
_____________;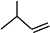 ___________。
___________。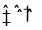 5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是__________ 。
5N2(g)+6H2O(g)。该反应已达到平衡状态的标志是__________ 。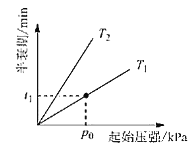
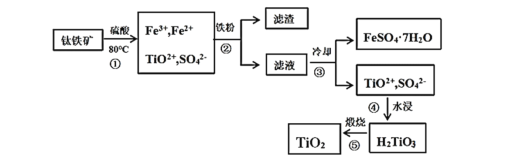
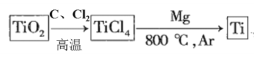
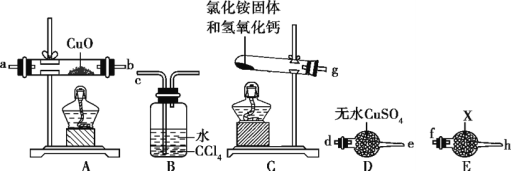
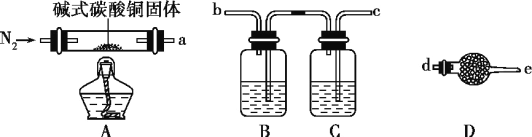
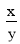 =________(列出表达式)
=________(列出表达式)