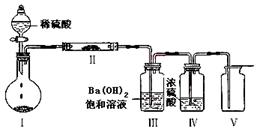
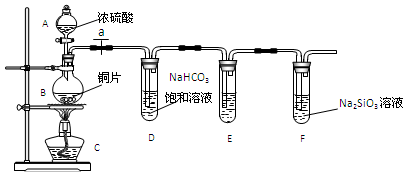
-
下列说法正确的是( )
A.电池放电时,电能转变为化学能
B.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需任何条件就可以进行
难度: 简单查看答案及解析
-
下列化学用语书写正确的是( )
A.次氯酸的结构式:H-Cl-O
B.氯化镁的电子式:
C.作为相对原子质量测定标准的碳核素: 614C
D.用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
下列既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与水蒸气的反应 D.甲烷(CH4)在O2中的燃烧反应
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.标准状况时,22.4L四氯化碳所含有的分子数为NA
B.34g H2O2中含有的非极性共价键数为 NA
C.碱性锌锰电池中,当有1.3g的锌消耗,则转移的电子数为0.002NA
D.将16gO2与64gSO2在一定的条件下充分反应生成的SO3分子数为NA
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.用硫氰化钾溶液检验溶液中的Fe3+: Fe3++3SCN-=Fe(SCN)3↓
B.钢铁生锈的负极电极反应: Fe —3e—= Fe3+
C.证明氯气氧化性大于硫可用: Cl2+S2-=2Cl-+S↓
D.用钠与硫酸铜溶液反应证明钠的金属性更强: 2Na+Cu2+=Cu+2Na+
难度: 困难查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A.①④ B.②③⑤ C.①③④ D.①②③④⑤
难度: 困难查看答案及解析
-
在不同条件下分别测得反应2SO2+O2
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A.v(SO2)=4 mol·L-1·min-1 B.v (O2)=3 mol·L-1·min-1
C.v (SO3)="0.1" mol·L-1·s-1 D.v (O2)=0.1mol·L-1·s-1
难度: 中等查看答案及解析
-
在一个密闭容器中用等物质的量的A和B发生反应:A(g)+3B(g)
2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
A.50% B.60% C.70% D.无法计算
难度: 中等查看答案及解析
-
为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气
泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现
电流计指针偏转.
下列关于以上实验设计及现象的分析,不正确的是( )
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。
下列叙述中不正确的是( )
A.WZ2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型相同
C.WX2是以极性键结合成的直线型分子
D.原子半径大小顺序是W<X<Y<Z
难度: 困难查看答案及解析
-
在N2+3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol·L-1,在此时间内用H2表示的反应速率为0.45mol·L-1·s-1,则该反应所经历的时间是( )
A.0.44s B.1s C.1.33s D.2s
难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法正确的是 ( )
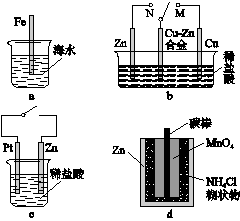
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn—MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 中等查看答案及解析
-
下列四个选项中,可由甲推导出结论乙的是( )
甲 乙
A 某过程发生能量变化 该过程发生化学反应
B 两种元素同一主族 两种元素的原子最外层电子数相同
C A原子失去的电子比B原子的多 A单质的还原性比B单质的强
D 某物质是离子化合物 该物质中一定含有金属元素
难度: 中等查看答案及解析
-
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ( )
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物不能相互反应
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应N2(g)+3H2(g)
2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.C1:C2=1:3
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2、H2的转化率之比为1:3
D.C1的取值范围为0.04 mol·L-1<C1<0.14 mol·L-1
难度: 中等查看答案及解析