-
如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+2)的元素不可能位于( )
A. ⅥA B. ⅣB C. ⅢB D. ⅣA
难度: 简单查看答案及解析
-
共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力。有下列物质:①Na2O2 ②冰 ③金刚石 ④碘单质 ⑤CaCl2 ⑥白磷,只含有两种作用力是( )
A.①④⑥ B.①③⑥ C.②④⑤ D.①②③⑤
难度: 中等查看答案及解析
-
下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体原子的核外电子排布相同
难度: 中等查看答案及解析
-
下列各组物质的晶体中,所含化学键类型全部相同,熔化时所克服的作用力也完全相同是
A.CO2和SiO2
B.NaCl和HCl
C.(NH4)2CO3和CO(NH2)2(尿素)
D.NaH和KCl
难度: 简单查看答案及解析
-
“类推”是常用的学习方法,下列类推的结论中,正确的是( )
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.存在离子键的化合物是离子化合物,则存在共价键的是共价化合物
D.Cl2+H2O=HCl+HClO,所以F2+H2O=HF+HFO
难度: 中等查看答案及解析
-
某元素 R 的最高价氧化物的水化物分子式是 HnRO2n﹣2,则在气态氢化物中 R 元素的化合价是( )
A.3n﹣10 B.12﹣3n C.3n﹣4 D.3n﹣12
难度: 简单查看答案及解析
-
下列有关碱金属、卤素结构和性质描述正确的是
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O
④砹是原子序数最大的卤族元素,根据卤素性质的递变规律,At与H2化合最容易
⑤根据HF、HCl、HBr、HI的稳定性逐渐减弱的事实,推出F、Cl、Br、I的非金属性递增的规律
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A.全部正确 B.⑦⑧ C.①③⑤⑥⑦ D.①③⑦⑧
难度: 中等查看答案及解析
-
对于元素周期表,下列叙述中不正确的是
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.元素周期表中位置靠近的元素性质相近
难度: 简单查看答案及解析
-
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
A.质子数:c>b
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
难度: 中等查看答案及解析
-
某短周期元素原子最外层只有2个电子,则该元素
A.一定是金属元素
B.一定是第ⅡA族元素
C.一定在化合物中呈+2价
D.可能是金属元素,也可能不是金属元素
难度: 简单查看答案及解析
-
X2﹣的核外电子排布为2、8、8,则X元素在周期表中的位置是
A. 第三周期0族 B. 第三周期ⅥA族
C. 第四周期IA族 D. 第三周期ⅦA族
难度: 简单查看答案及解析
-
1989年,IUPAC(国际纯粹与应用化学联合会)建议用1-18列替代原主族、副族等。下列有关说法错误的是( )
A.非金属性最强的元素位于元素周期表的第18列
B.金属性最强的元素位于元素周期表的第1列
C.元素周期表中第3列的元素种类数最多
D.能形成化合物的种类数最多的元素位于元素周期表的第14列
难度: 简单查看答案及解析
-
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,根据碱金属元素性质的递变规律预测其性质,其中不正确的是
A.在碱金属元素中它具有最大的原子半径
B.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
C.它的氢氧化物的化学式为FrOH,这是一种极强的碱
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸
难度: 中等查看答案及解析
-
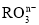 中共有x个电子,R原子的质量数为A,则a克
中共有x个电子,R原子的质量数为A,则a克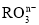 中含有质子的物质的量为( )
中含有质子的物质的量为( )A.
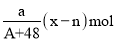 B.
B.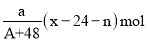
C.
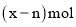 D.
D.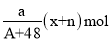
难度: 简单查看答案及解析
-
某元素W的原子结构示意图为
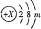 ,下列说法不正确的是
,下列说法不正确的是A. W处于元素周期表的第三周期
B. m=7,W形成的单质可用于自来水消毒
C. m=1,W的最高价氧化物对应的水化物是一种弱碱
D. m=6,W可以形成化学式为WO2的氧化物
难度: 中等查看答案及解析
-
一种粒子的质子数和电子数与另一种粒子的质子数和电子数均相等,则下列关于两种粒子之间的关系说法错误的是 ( )
A.可能互为同位素 B.可能是两种分子
C.可能是两种离子 D.可能是一种分子和一种离子
难度: 中等查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
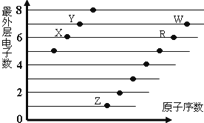
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
难度: 中等查看答案及解析
-
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A.氢键比分子间作用力强,所以它属于化学键
B.冰中存在氢键,水中不存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.二氧化硅的分子式:SiO2 B.H2O2的电子式:
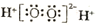
C.Cl−的结构示意图:
 D.原子核中有10 个中子的氧离子:
D.原子核中有10 个中子的氧离子: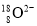
难度: 简单查看答案及解析
-
下列能够证明氯的非金属性比硫强的事实是
①HClO3酸性比H2SO4强
②HCl酸性比H2S强
③HCl稳定性比H2S强
④HCl还原性比H2S弱
⑤Cl2与H2S反应生成S
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
⑦Na2S可与HCl反应生成H2S
A.①③⑤⑥ B.②③④⑤⑥ C.③⑤⑥⑦ D.③④⑤⑥
难度: 困难查看答案及解析
-
下列说法不正确的是( )
①
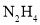 分子中既含极性键又含非极性键
分子中既含极性键又含非极性键②若
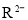 和
和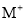 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数: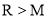
③
 、
、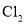 、
、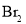 、
、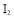 熔点随相对分子质量的增大而升高
熔点随相对分子质量的增大而升高④
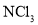 、
、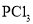 、
、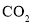 、
、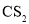 分子中各原子均达到
分子中各原子均达到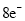 稳定结构
稳定结构⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥
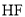 分子很稳定是由于
分子很稳定是由于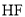 分子之间能形成氢键
分子之间能形成氢键⑦由于非金属性:
 ,所以酸性:
,所以酸性:
A.②⑤⑥⑦ B.①③④⑤ C.②④⑤ D.③⑤⑦
难度: 中等查看答案及解析
-
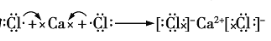
下列有关化学用语的表示错误的是
A.次氯酸的电子式为
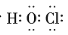
B.R2+有a个电子、b个中子,R的原子符号为
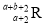
C.用电子式表示CaCl2的形成过程为
D.Na+的结构示意图为
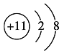
难度: 简单查看答案及解析
-
下列有关化学用语表达正确的是( )
A.氮气的电子式:
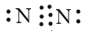 B.CO2的电子式:
B.CO2的电子式: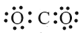
C.NH4Cl的电子式:
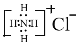 D.钙离子的电子式:Ca2+
D.钙离子的电子式:Ca2+难度: 简单查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl
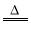 NH3↑+HCl↑
NH3↑+HCl↑B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是( )
序号
实验操作
实验目的
A
铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜
比较钠与铁的金属性强弱
B
向MgCl2、AlCl3溶液中分别通入NH3
比较镁、铝的金属性强弱
C
酸性H2CO3<H2SO4
比较碳、硫的非金属性强弱
D
酸性HCl >H2S
比较氯、硫的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是
A.
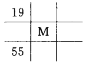 B.
B. C.
C.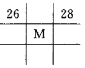 D.
D.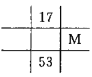
难度: 简单查看答案及解析
-
下列表示电子式的形成过程正确的是
A.
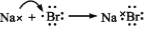
B.
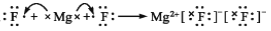
C.
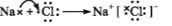
D.
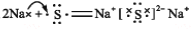
难度: 中等查看答案及解析
-
关于离子化合物 NH5,下列说法正确的是
A.N 为-5 价
B.阴阳离子个数比是 1:1
C.阴离子为 8 电子稳定结构
D.阳离子的电子数为 11
难度: 简单查看答案及解析
-
以下说法不正确的是( )
A.C60与金刚石互为同素异形体
B.氢键属于化学键
C.金属元素和非金属元素形成的化合物在熔融状态下不一定能导电
D.“NH4Cl”的意义是指氯化铵晶体由NH
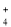 和Cl-构成,阴、阳离子个数比为1:1
和Cl-构成,阴、阳离子个数比为1:1难度: 中等查看答案及解析
-
Y元素最高正价与负价的绝对值之差是4,Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A.K2S B.Na2S C.Na2O D.KCl
难度: 简单查看答案及解析
-
下列粒子
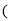 分子或离子
分子或离子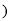 均含有18个电子:
均含有18个电子:粒子
A+
B2-
C
D
E
F
组成特点
单核离
化合物,
双核分子
单质,
双核分子
化合物,
三核分子
化合物,
四核分子
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是
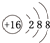
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,则下列说法错误的是( )
A.1 mol HD中含有的中子数为NA
B.标准状况下,22.4 L
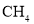 中含有5NA个原子
中含有5NA个原子C.117号元素的符号为Ts,其氢化物
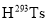 中含有的中子数为176NA
中含有的中子数为176NAD.16g
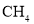 中含有个4NA个C—H键
中含有个4NA个C—H键难度: 中等查看答案及解析
-
短周期元素 W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图。下列说法错误的是 ( )
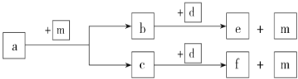
A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y>X
C.a一定是烃
D.d中既含有离子键又含有共价键,其中阳离子和阴离子的数目之比为2∶1
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
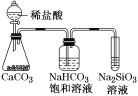
D.用中文“
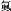 ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族难度: 中等查看答案及解析