-
猜想与假设是基于部分证据得出的不确定结论。下列猜想与假设不合理的是
A. Ca与H2O反应可能生成H2
B. SO2和H2O2反应可能生成H2SO4
C. 浓硫酸与乙醇在一定条件下反应产生的黑色物质可能是碳单质
D. H2C2O4溶液与H2SO4酸化的KMnO4溶液反应,先慢后快,催化剂可能是K+
难度: 困难查看答案及解析
-
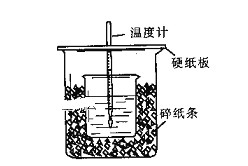
测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
A. ①②⑥⑦ B. ②⑤⑦⑧ C. ②③⑦⑧ D. ③④⑤⑦
难度: 简单查看答案及解析
-
一定条件下。RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列叙述正确的是
A.元素R位于周期表中第ⅤA族
B.RO3-中的R只能被还原
C.R2在常温下一定是气体
D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
下列有关化学及人类社会发展历程的说法中,不正确的是
A.道尔顿的“原子论”和阿伏加德罗的“分子学说”对化学的发展起到了极大的推动作用
B.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
C.半导体器件的研制开始于锗,后来发展到研制与它同族的硅
D.化石燃料的使用,极大地促进了生产力的发展,但同时又伴随着能源危机和环境问题
难度: 简单查看答案及解析
-
R、X、Y、Z、W是短周期主族元素,它们在元素周期表中的相对位置如图所示。R最高价氧化物对应水化物与其简单气态氢化物反应可以形成离子化合物。下列推断正确的是
R
X
Y
Z
W
A.最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y
B.R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8
C.最高价氧化物的水化物酸性由弱到强的排Z、R、W
D.RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构
难度: 中等查看答案及解析
-
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、O=O键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )
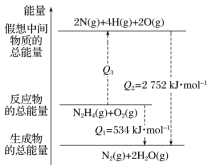
A.194 B.391 C.516 D.658
难度: 简单查看答案及解析
-
下列说法正确的有几项
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.2项 B.3项 C.4项 D.5项
难度: 简单查看答案及解析
-
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4O10,下列有关P4S3的说法中不正确的是( )
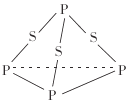
A.P4S3属于共价化合物
B.1mol P4S3分子中含有9mol共价键
C.P4S3充分燃烧的化学方程式为P4S3+8O2
 P4O10+3SO2
P4O10+3SO2D.P4S3中磷元素为+3价
难度: 简单查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F
B.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料
C.短周期元素正化合价数值和其族序数相同
D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+
难度: 中等查看答案及解析
-
某反应由两步反应A
 B
B C构成,它的反应能量曲线如图,下列叙述正确是( )
C构成,它的反应能量曲线如图,下列叙述正确是( )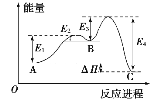
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.A与C的能量差为E4
D.A
 B反应,反应条件一定要加热
B反应,反应条件一定要加热难度: 中等查看答案及解析
-
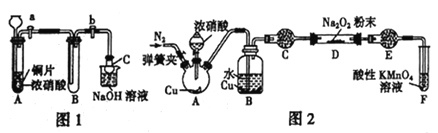
某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2===Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
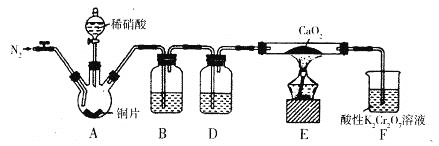
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
难度: 困难查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ/mol
H2(g)+
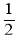 O2(g)=H2O(l) ΔH=-285.84 kJ/mol
O2(g)=H2O(l) ΔH=-285.84 kJ/mol在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-319.68 kJ/mol B.-417.91 kJ/mol
C.-448.46 kJ/mol D.+546.69 kJ/mol
难度: 中等查看答案及解析
-
下列不能说明氯元素的非金属性比硫元素的强的有几项
①HCl比H2S稳定
②HClO的氧化性比H2SO4强
③Cl2能与H2S反应生成S
④HCl的溶解度比H2S大
⑤Cl2与Fe反应生成FeCl3,S与Fe生成FeS
⑥HCl的酸性比H2S强
A.3项 B.4项 C.5项 D.6项
难度: 简单查看答案及解析
-
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化,Z是NO,下列推 断不合理的是
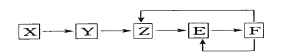
A.X可能是一种氢化物 B.X生成Z一定是化合反应
C.E可能是一种有色气体 D.F中M元素的化合价可能为+5
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
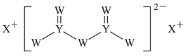
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
难度: 困难查看答案及解析
-
1.92g 铜投入一定量浓 HNO3 中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL 气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的 O2,恰好使气体完全溶于水中,则通入O2 的体积可能是
A.504mL B.168mL C.336mL D.224mL
难度: 中等查看答案及解析
 C+D↑,则A+、Bˉ的电子式:___________,____________。
C+D↑,则A+、Bˉ的电子式:___________,____________。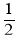 N2(g)+
N2(g)+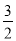 H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g)ΔH1=+akJ·mol-1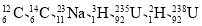 中共有____种元素,_____种核素。
中共有____种元素,_____种核素。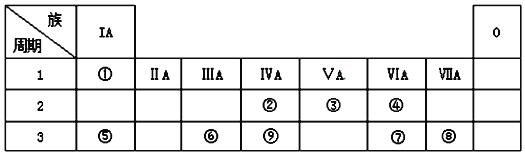
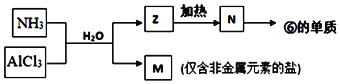
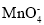 反应生成
反应生成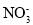 和Mn2+。
和Mn2+。