-
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
难度: 中等查看答案及解析
-
下列说法在一定条件下可以实现的有( )
①酸性氧化物与碱发生反应生成酸式盐 ②弱酸与盐溶液反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种氧化物反应的产物有气体
A. 6个 B. 5个 C. 4个 D. 3个
难度: 中等查看答案及解析
-
已知将Fe3O4看作为(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为:3Fe2+ +2S2O32- +O2 +4OH- = Fe3O4 +S4O62- +2H2O,下列说法正确的是( )
A. O2和S2O32-是氧化剂,Fe2+ 是还原剂
B. 每生成1 mol Fe3O4,转移2 mol电子
C. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
难度: 困难查看答案及解析
-
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol • L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为( )(反应前后溶液体积变化忽略不计)
A. 0.225 mol • L-1 B. 0.30 mol • L-1 C. 0.36 mol • L-1 D. 0.45 mol • L-1
难度: 简单查看答案及解析
-
纵观古今,化学与生活皆有着密切联系。下列有关说法错误的是( )
A. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同
B. 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色
C. 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙
D. 芒硝晶体(Na2SO4·10H2O)白天在阳光下曝晒后失水、溶解吸热,晚上重新结晶放热,实现了太阳能转化为化学能继而转化为热能
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是( )
A. 疫苗一般应冷藏存放,以避免蛋白质变性
B. 泡沫灭火器可用于一般的起火,也适用于电器起火
C. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 2 L 0.5 mol·L-1CH3COOH溶液中,CH3COO- 的数目为NA
B. 一定质量的某单质,若含质子数为n NA,则中子数一定小于nNA
C. 标准状况下,22.4LHF含有的共价键数为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期元素,X2- 和Y+的核外电子排布相同;Z电子层数与最外层电子数相等,W原子是同周期主族元素中半径最小的。下列说法正确的是( )
A. 简单离子半径:Z>W>X>Y
B. X的氢化物中不可能含有非极性键
C. 由X 与Y两种元素组成的物质可能有漂白性
D. 元素Y、Z 的氧化物的水化物之间相互反应生成的盐溶液呈中性
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2 溶液:Mg2++2Cl-+2H2O
 Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3
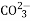
 Al2(CO3)3↓
Al2(CO3)3↓C. 向Ca(HCO3)2 溶液中滴加少量NaOH溶液:Ca2++2
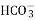 +2OH-
+2OH- CaCO3↓+
CaCO3↓+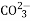 +2H2O
+2H2OD. 向Fe(NO3)3溶液中加入过量的HI 溶液:2
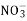 +8H++6I-
+8H++6I- 3I2+2NO↑+4H2O
3I2+2NO↑+4H2O难度: 困难查看答案及解析
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列说法正确的是( )
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O+4e-=O2↑+4H+
B. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物可能为H3PO4
C. H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-= PO23-+3H2O
D. H3PO2溶于水的电离方程式为H3PO2
 H++H2PO2-
H++H2PO2-难度: 中等查看答案及解析
-
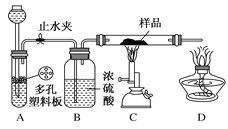
按如图装置进行实验,下列推断正确的是( )
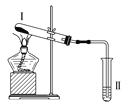
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
铁粉与水蒸气发生了反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
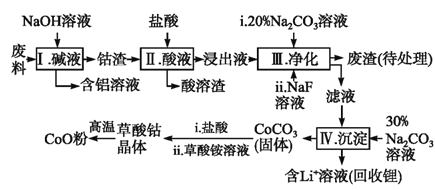
茶叶中铁元素检验可用以下步骤完成,各步骤选用实验用品不能都用到的是( )
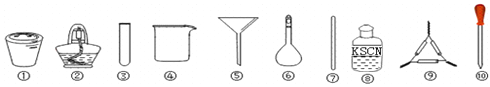
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 过滤得到滤液,选用④、⑤和⑦
C. 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
难度: 简单查看答案及解析
-
用如图所示装置进行锌与稀硫酸反应速率的测定。下列说法错误的是( )
甲装置:
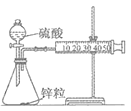 乙装置:
乙装置: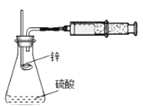
A. 将甲装置分液漏斗旋塞打开,分液漏斗里的液体顺利流下,并不能说明整套装置气密性不好
B. 需要测量单位时间内产生气体的体积或产生一定体积的气体需要的时间
C. 甲装置因为逐滴加入硫酸,硫酸的体积和浓度的变化会造成误差,用乙装置可以减小该误差(乙装置中燃烧匙可上下移动)
D. 只需要将甲装置中锌粒改为铜片,稀硫酸改为浓硫酸,就可以用此装置测定铜与浓硫酸的反应速率
难度: 中等查看答案及解析
-
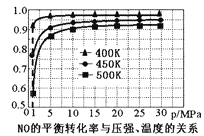
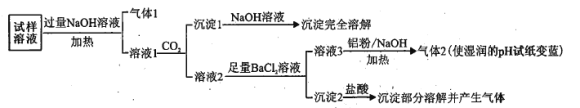
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是( )
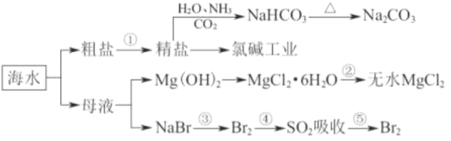
A. 工业上通过电解饱和MgCl2溶液制取金属镁
B. 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在③、④、⑤步骤中,溴元素均被氧化
D. 制取NaHCO3的反应是利用其溶解度比较小
难度: 中等查看答案及解析
-
苯甲酸钠(
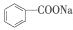 ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 当pH为5.0时,饮料中c(HA) /c(A–)=0.16
C. 提高CO2充气压力,饮料中c(A–)不变
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
难度: 中等查看答案及解析
-
室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
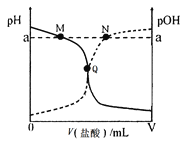
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
难度: 困难查看答案及解析