-
工业上常用电解法冶炼的金属是
A.Fe B.Al C.Cu D.Ag
难度: 简单查看答案及解析
-
下列方法中,不能用于区分乙酸溶液与乙醇溶液的是( )
A.扇闻气味 B.观察颜色
C.滴加NaHCO3溶液 D.滴加紫色石蕊溶液
难度: 简单查看答案及解析
-
2020年5月1日起,新版《北京市生活垃圾管理条例》正式实施,下列垃圾分类对应不正确的是




A. 鸡蛋壳、剩饭菜
B. 市民使用后一次性口罩
C. 过期药品
D. 一 次性干电池
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
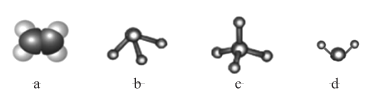
下列化学用语不正确的是
A.乙醇的分子式:C2H6O B.CH4的空间充填模型:

C.羟基的结构简式:OH D.Cl 的原子结构示意图:

难度: 简单查看答案及解析
-
下列反应属于加成反应的是
A.乙烯与氢气反应生成乙烷 B.乙醇与钠反应生成乙醇钠
C.甲烷与氯气反应生成一氯甲烷 D.乙酸与乙醇反应生成乙酸乙酯
难度: 简单查看答案及解析
-
下列实验装置或操作与实验目的不相符的是


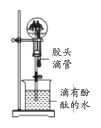
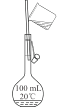
A. 证明铜与硝酸的反应
B. 分离乙醇和乙酸的混合液
C. 证明氨气易溶于水且水溶液呈碱性
D. 配制100 mL0.100 mol/LNaCl溶液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质中与 CH3CH2CH2CH3互为同分异构体的是
A.CH3CH2CH3 B.
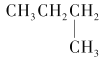 C.
C.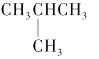 D.CH3CH = CHCH3
D.CH3CH = CHCH3难度: 简单查看答案及解析
-
原电池原理的发现和各种电池的发明,改变了人们的生活方式。下图所示原电池装置的相关说法中,不正确的是

A.能将化学能转化为电能
B.电子从 Cu 经导线流向 Zn
C.溶液中H+、
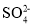 分别向铜、锌电极移动
分别向铜、锌电极移动D.该装置中发生的总反应为: Zn + 2H+ = Zn2+ + H2↑
难度: 简单查看答案及解析
-
在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下 ,下列有关说法不正确的是
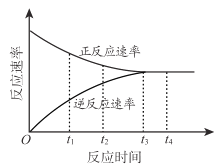
A.t1 时刻,反应向逆反应方向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,反应刚好达到平衡状态
D.t4时刻,反应限度保持不变
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g C2H4中所含共价键数目为4NA
B.1 mol/L NaOH溶液中 Na+的数目为NA
C.标准状况下,11. 2 L CC14 中含有的分子数为 0.5 NA
D.2.4g 镁粉与足量盐酸反应转移电子的数目为0.2 NA
难度: 简单查看答案及解析
-
某化学小组为了探究铝电极在原电池中的作用,进行了下列实验,实验结果记录如下。下列说法正确的是
编号
电极材料
电解质溶液
电流表指针偏转方向
①
Mg 、 Al
稀盐酸
偏向 Al
②
Al 、Cu
稀盐酸
偏向 Cu
③
Al 、石墨
稀盐酸
偏向
④
Mg 、Al
NaOH 溶液
偏向 Mg
A.实验①和②中,Al 电极的作用相同
B.实验③中,电流表指针偏向 Al
C.实验④中,Mg 为负极 ,电极反应式为:Mg - 2e-= Mg2+
D.综合以上实验,铝在原电池中的作用 ,与另一个电极材料和电解质溶液有关
难度: 中等查看答案及解析
-
不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )
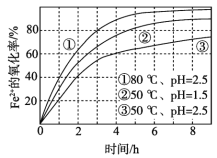
A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
难度: 简单查看答案及解析
-
某温度时,在 2L 容器中发生 A 、B 两种物之间的转化反应 ,A、B 物质的量随时间变化的曲线如图所示,下列说法正确的是
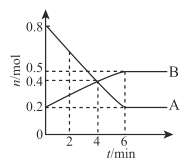
A.该反应的化学方程式是A
 2B
2BB.2 min 时,正反应速率大于逆反应速率
C.4 min 时,A 、B 的物质的量相等且反应达到了平衡状态
D.反应开始至 6min,A 的平均反应速率为0. lmol/(L•min)
难度: 简单查看答案及解析
-
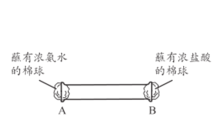
某化学小组通过下列实验探究 KI 与FeCl3溶液的反应,实验过程和现象如下 。
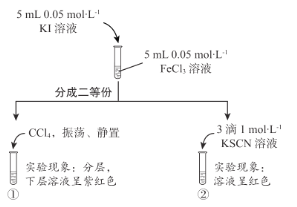
下列说法不正确的是
A.试管①中现象证明有I2生成
B.试管②中现象证明溶液中存在Fe3+
C.KI 与FeCl3溶液的反应方程式为:2Fe3++ 2I-=2Fe2+ + I2
D.综合该实验可推知,Fe3+和I2都具有氧化性
难度: 中等查看答案及解析

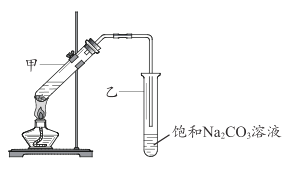

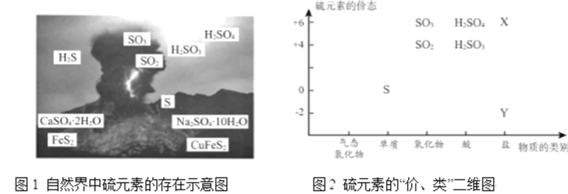
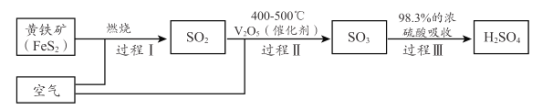
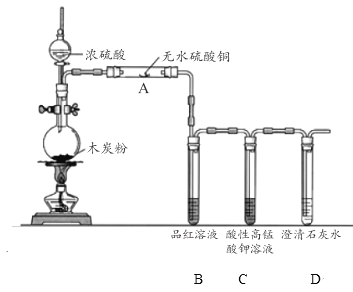

 。
。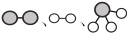 )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气) 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。