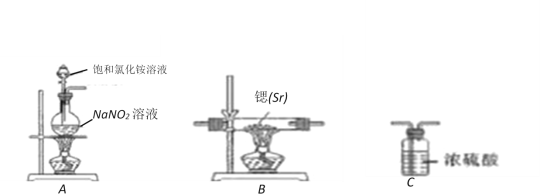
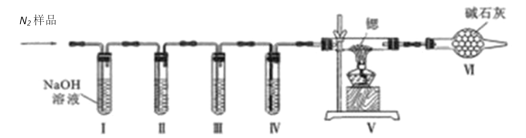
-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 春秋战国时期我国已经开始大规模生产丝绸制品,其主要成分为纤维素。
B. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土。
C. 晚唐时候发明了黑火药,其爆炸时发生了剧烈的氧化还原反应。
D. 二十世纪初我国化学工程专家侯德榜发明的侯氏制碱法又称联合制碱法,该方法中涉及到如下反应:NaCl + CO2+NH3+H2O=NaHCO3↓+NH4Cl
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,5.6L甲烷和乙烯的混合气体中含氢原子数为NA
B. 7.8g Na2O2中所含阴阳离子的总数为0.3NA
C. 将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成氢气分子数为0.1NA
D. 反应2KNO3+3C+S =N2↑+ 3CO2↑+K2S,每生成0.1mol N2转移电子数为NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. X的简单氢化物的热稳定性比W的强
B. 简单离子的半径:X2->Y+
C. Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O
 2Cu+O2↑+4H+
2Cu+O2↑+4H+D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
难度: 困难查看答案及解析
-
根据下列实验及其现象所得到的结论正确的是
选项
实验
现象
结论
A
将铝片放入冷的浓硝酸中
无明显现象
铝和浓硝酸不反应
B
将SO2通入新制氯水中
溶液褪色
SO2有漂白性
C
向1mL 1mol·L-1 AgNO3溶液中加入几滴NaCl溶液(浓度为1mol·L-1),振荡后又加入几滴KI溶液
先产生白色浑浊,然后白色浑浊变成黄色
Ksp(AgI)比Ksp(AgCl)小
D
将氯化铵固体溶于水
溶液温度降低
无法判断盐类水解过程吸热还是放热
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
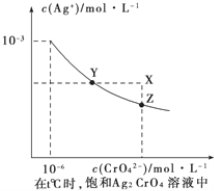
A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)
 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107难度: 中等查看答案及解析
-
下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质所形成的化学电源;乙利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是
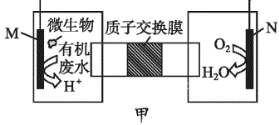
A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.0lmolCr2O72-,则电路中至少转移了0.12 mol电子
难度: 中等查看答案及解析
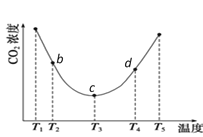
 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图: