-
化学与生产、生活和技术密切相关,下列说法错误的是
A.75%的酒精能杀死冠状病毒,是利用了它使病毒中的蛋白质变性
B.聚乙炔用I2或Na处理后可形成能导电的塑料,该塑料有固定的熔沸点
C.硝化甘油是治疗心绞痛药物的主要成分,该物质属于酯类化合物
D.乙二醇的水溶液凝固温度可达-50℃,它常用于汽车发动机的防冻液
难度: 中等查看答案及解析
-
下列方程式书写正确的是
A.苯酚与Na2CO3 溶液反应:2
 +Na2CO3→2
+Na2CO3→2 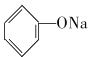 +CO2↑+H2O
+CO2↑+H2OB.甲苯与Cl2发生取代反应:
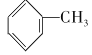 +Cl2
+Cl2 
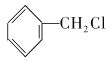 +HCl
+HClC.氯乙烷与 NaOH水溶液共热:CH3CH2Cl +NaOH
 CH2=CH2↑+NaCl+ H2O
CH2=CH2↑+NaCl+ H2OD.丙醇氧化:2CH3CH(OH)CH3+O2
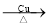 2CH3CH2CHO+2 H2O
2CH3CH2CHO+2 H2O难度: 中等查看答案及解析
-
下列电子排布图(轨道表示式)中,所表示氮原子的能量状态最高的是
A.
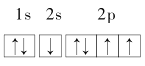 B.
B.
C.
 D.
D.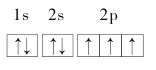
难度: 简单查看答案及解析
-
下列化学用语书写错误的是
A.Fe原子结构示意图:

B.乙基的结构式:

C.丙烯的结构简式:CH3CHCH2
D.碳碳双键的电子式:
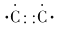
难度: 简单查看答案及解析
-
下列基态原子的价电子排布不可能的是
A.3d44s2 B.4s2 C.3d74s2 D.4s24p5
难度: 简单查看答案及解析
-
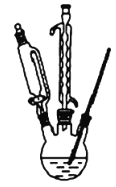
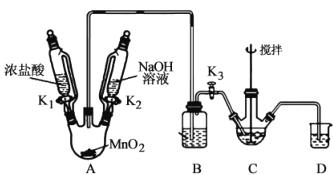
某兴趣小组设计实验探究石油分馏过程,反应装置如图所示,下列关于实验的装置、操作叙述正确的是

A.为了准确测量温度,温度计球泡应浸入反应液中
B.冷凝水从d管口进入,能够增加冷凝效果
C.控制温度,锥形瓶中可得到某种纯净物
D.实验前需向蒸馏烧瓶中加入碎瓷片防止暴沸
难度: 中等查看答案及解析
-
CO2常用于灭火,但镁可以在CO2中剧烈燃烧:2Mg+CO2
 2MgO+C,生成的氧化镁熔点高达2800℃。下列有关说法错误的是
2MgO+C,生成的氧化镁熔点高达2800℃。下列有关说法错误的是A.该反应利用了Mg的强还原性
B.氧化镁属于离子晶体
C.CO2 和C(石墨)中的C原子的杂化方式相同
D.干冰中每个CO2周围有12个CO2 分子
难度: 困难查看答案及解析
-
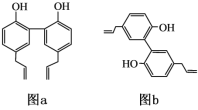
下列关于有机物命名错误的是
A.CH3C≡CCH3:丁炔
B.
 :3,5-二甲基苯酚
:3,5-二甲基苯酚C.
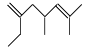 :4,6-二甲基-2-乙基-1,5-庚二烯
:4,6-二甲基-2-乙基-1,5-庚二烯D.
 :3-羟基己醛
:3-羟基己醛难度: 简单查看答案及解析
-
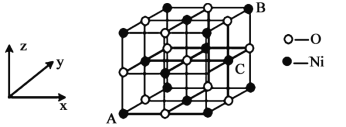
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。氧化镍原子分数坐标参数A为(0,0,0),B为(1,1,1),则C的坐标参数为
A.(
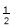 ,
,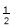 ,
,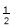 ) B.(1,1,
) B.(1,1,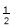 ) C.(
) C.(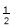 ,1,
,1,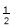 ) D.(1,
) D.(1,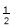 ,
,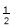 )
)难度: 中等查看答案及解析
-
一定条件下,乙二酸和乙二醇发生反应,不可能生成的有机物是
A.CH2=CH2
B.HOOC-COOCH2-CH2OH
C.
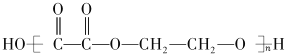
D.

难度: 中等查看答案及解析
-
下列操作不能达到相应实验目的的是
实验目的
操作
A
检验绿茶中是否含有酚类物质
向茶水中滴加FeCl3溶液
B
鉴别乙酸、丙醛和甲酸
用试管取试剂,分别加入适量新制Cu(OH)2浊液,加热
C
除去苯中少量苯酚
向苯和苯酚混合液中加入NaOH溶液充分反应,静置后分液
D
制备乙酸乙酯
向试管中加入乙酸、乙醇和碎瓷片,加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某同学用如图所示的装置制取溴苯。下列说法错误的是
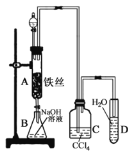
A.装置C中的CCl4可以用苯替代
B.反应完毕后,向试管D中滴加AgNO3溶液有淡黄色沉淀生成,证明发生了取代反应
C.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,B中出现分层现象
D.将分液后的B中水层溶液蒸发至干,再灼烧可制得无水FeBr3
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期元素,b、a、d、c为上述四种元素形成的单质,m、n、p为四种元素形成的二元化合物,其转化关系如图所示。W与同周期原子半径最大的元素组成的化合物溶液呈中性,n为一种传递神经信息的“信使分子”。下列说法错误的是
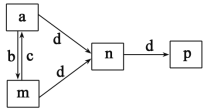
A.a的熔点比d的熔点低
B.Y、Z、W的简单离子半径大小顺序为:Y<Z<W
C.X、Z组成的分子可能既含有极性键,又含有非极性键
D.在工业上c可大量用于制造有机溶剂和杀菌消毒剂
难度: 困难查看答案及解析
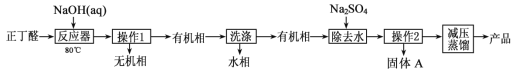
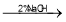
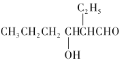
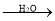
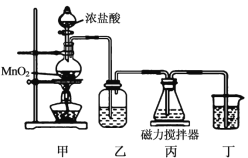
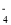 (已知:H2C2O4+ MnO
(已知:H2C2O4+ MnO
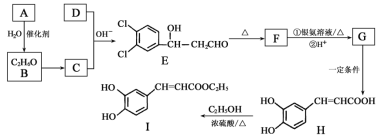
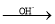
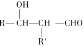

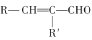
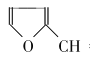 =CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。
=CHCOOH )是一种医治血吸虫病的药物呋喃丙胺的原料。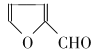 、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)______ 。
、CH3CH2OH为原料制备呋喃丙烯酸的合成路线(无机试剂任选)______ 。