-
下列有关化学用语表示正确的是
A.含有173个中子的113号元素符号
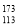 Nh B.H2O与D2O互称为同素异形体
Nh B.H2O与D2O互称为同素异形体C.NaOH的电子式:
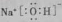 D.F的原子结构示意图:
D.F的原子结构示意图:
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN
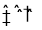 Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅D.2NO2(g)
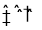 N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内v(N2)=0.2 mol·L-1·s-1,则3s末NH3的浓度为
A.0.4 mol·L-1 B.0.6 mol·L-1 C.0.9 mol·L-1 D.1.2 mol·L-1
难度: 简单查看答案及解析
-
N2和H2在催化剂表面合成氨气反应的能量变化如图,下列说法正确的是
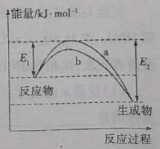
A.相同条件下,催化剂b的效果更好
B.使用催化剂,合成氨反应放出的热量减少
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
难度: 简单查看答案及解析
-
某温度下,对可逆反应2X(g) + Y(g)
 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是A. 加入少量W,逆反应速率增大,平衡向左移动
B. 增大压强,正反应速率增大,逆反应速率减小
C. 温度、体积不变,充入He气增大压强,反应速率会加快
D. 升高温度,混合气体的平均相对分子质量减小
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
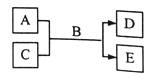
A.简单离子半径大小关系:Y>Z>X>W B.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>Z D.D的水溶液中含有阴、阳离子及共价键形成的分子
难度: 中等查看答案及解析
-
实验室从海藻中提取碘的流程如下:
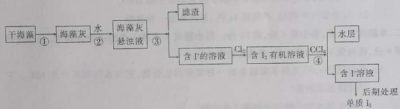
下列关于该流程中各步的装置和仪器的说法中错误的是
选项
步骤
采用装置
主要仪器
A
①
灼烧装置
蒸发皿
B
②
溶解装置
烧杯
C
③
过滤装置
漏斗
D
④
分液装置
分液漏斗
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关说法错误的是
A.分子中一定含有共价键
B.两种非金属元素形成的化合物中可能含有离子键
C.需要加热的反应不一定是吸热反应
D.化学键的断裂和形成是化学反应中能量变化的本质
难度: 简单查看答案及解析
-
下图所示为工业合成氨的流程图。有关说法错误的是
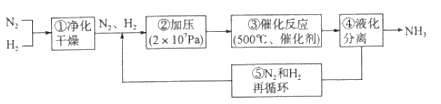
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料平衡的转化率
D.产品液氨除可生产化肥外,还可用作制冷剂
难度: 简单查看答案及解析
-
运用元素周期律知识,预测元素的单质及其化合物性质,下列预测错误的是
A.SrSO4是难溶于水的白色固体
B.H2Se比H2S易分解
C.At单质为有色固体,AgAt不溶于水也不溶于稀HNO3
D.Li在氧气中燃烧,产物是Li2O2,其溶液是一种强碱
难度: 中等查看答案及解析
-
目前海水提溴的最主要方法之一是空气吹出法,工艺流程如下:

以下推断不合理的是
A.流程中循环利用的物质有SO2、Br2、Cl2,等多种
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.空气能吹出溴是利用溴易挥发的性质
D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
难度: 中等查看答案及解析
-
X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
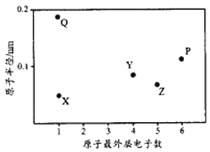
A.Q的氧化物一定含有离子键和共价键 B.最高价含氧酸的酸性:Z<Y
C.P的最低价氢化物常温常压下为液体 D.Y形成的化合物种类最多
难度: 中等查看答案及解析
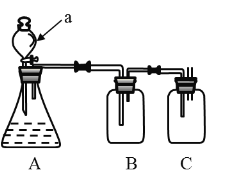
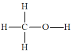 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)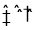 CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。 mol-1)
mol-1)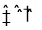 N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
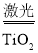 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题: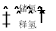 HCOONa+H2O。下列有关说法正确的是____。
HCOONa+H2O。下列有关说法正确的是____。