-
下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )。
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤含I2的淀粉溶液
A. ①④ B. ①②③
C. ②③⑤ D. ③⑤
难度: 中等查看答案及解析
-
下列各组化合物的性质比较中,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S
难度: 中等查看答案及解析
-
下列各电离方程式中,书写正确的是( )
A.H2S
 2H++S2- B.KHSO4
2H++S2- B.KHSO4 K++H++SO
K++H++SO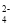
C.Al(OH)3=Al3++3OH- D.NaH2PO4=Na++H2PO
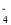
难度: 简单查看答案及解析
-
中国计量科学研究院研制的NIM5铯原子喷泉钟,2000 万年不差一秒,日前成为国际计量局认可的基准钟之一,参与国际标准时间修正。关于Cs元素,下列说法错误的是
A.137Cs和133Cs互为同位素 B.单质Cs与水反应非常缓慢
C.137Cs比133Cs多4个中子 D.137Cs最外层只有1个电子
难度: 简单查看答案及解析
-
下列溶液肯定显酸性的是
A.含 H+的溶液 B.加酚酞显无色的溶液
C.pH<7 的溶液 D.c(H+) >c(OH-)的溶液
难度: 简单查看答案及解析
-
对反应3NO2+H2O= 2HNO3+NO的下列说法正确的是( )
A.还原剂与氧化剂物质的量之比为2∶1
B.氧化产物与还原产物的物质的量之比为1∶2
C.NO2是氧化剂,H2O是还原剂
D.反应中若有6 mol NO2参与反应,则有3 mol电子发生转移
难度: 简单查看答案及解析
-
在25.00mL的蓝柄滴定管中盛有溶液,液面恰好在20.00mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A.5.0mL B.20.0mL C.大于5.0mL D.小于5.0mL
难度: 中等查看答案及解析
-
在恒容密闭容器中,可逆反应C(s)+CO2(g)
 2CO(g)达到平衡状态的标志是( )
2CO(g)达到平衡状态的标志是( )①单位时间内生成n molCO2的同时生成n molC
②单位时间内生成n molCO2 的同时生成2n mol CO
③CO2 、CO的物质的量浓度之比为1: 2的状态
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥C的质量不再改变的状态
A.①④⑤⑥ B.②④⑤⑥ C.②③⑤⑥ D.①②③④
难度: 中等查看答案及解析
-
某温度下,在密闭容器中发生如下反应2A(g)+B(g)
 2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )
2C(g),若开始时充入2molC气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molA和1molB的混合气体,达到平衡时A的转化率为( )A.20% B.40% C.60% D.80%
难度: 困难查看答案及解析
-
把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b为正极,则四种金属活动性顺序由强到弱为( )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
可逆反应mA(固)+nB(气)
 pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是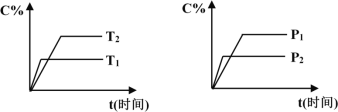
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度、化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
难度: 简单查看答案及解析
-
在室温下,某无色溶液中由水电离出的H+浓度为1.0×10-13 mol·L-1,则此溶液中一定能大量存在的离子组是( )
A.Fe3+、NO
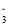 、Cl-、Na+ B.Ca2+、HCO
、Cl-、Na+ B.Ca2+、HCO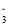 、Cl-、K+
、Cl-、K+C.NH
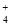 、Fe2+、SO
、Fe2+、SO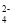 、NO
、NO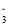 D.Cl-、SO
D.Cl-、SO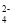 、K+、Na+
、K+、Na+难度: 简单查看答案及解析
-
下列有关反应热的说法正确的是( )
A.在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量
B.甲烷的燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890 kJ·mol-1
C.1 mol甲烷气体和2 mol氧气的总能量小于1 mol二氧化碳气体和2 mol液态水的总能量
D.已知:S(s)+O2(g)= SO2(g) ΔH1=-Q1 kJ·mol-1,S(g)+O2(g)= SO2(g) ΔH2=-Q2 kJ·mol-1,则Q1<Q2
难度: 简单查看答案及解析
-
下列叙述正确的是
A.在醋酸溶液的
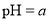 ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的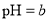 ,则
,则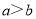
B.在滴有酚酞溶液的氨水里,加入
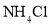 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的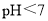
C.
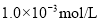 盐酸的
盐酸的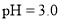 ,
,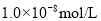 盐酸的
盐酸的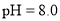
D.若1mL
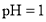 的盐酸与100mL
的盐酸与100mL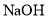 溶液混合后,溶液的
溶液混合后,溶液的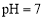 则
则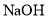 溶液的
溶液的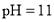
难度: 中等查看答案及解析
-
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是
A.X=Y=Z B.X<Y=Z C.X>Y=Z D.X=Y<Z
难度: 简单查看答案及解析
-
把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A.10∶1 B.1∶10
C.1∶100 D.1∶2
难度: 简单查看答案及解析
 2PbSO4+2H2O。根据上述情况判断:
2PbSO4+2H2O。根据上述情况判断: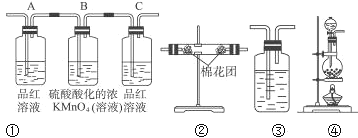
 2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=____mol/(L·min),N2的平衡转化率为___,2000 K时该反应的平衡常数K=___。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000 K时,向容积为2 L的密闭容器中充入2 mol N2与2 mol O2,发生上述反应,经过5 min达到平衡,此时容器内NO的体积分数为0.75%,则该反应在5 min内的平均反应速率v(O2)=____mol/(L·min),N2的平衡转化率为___,2000 K时该反应的平衡常数K=___。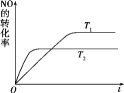
 N2(g)+O2(g)为____反应(填“吸热”或“放热”)。
N2(g)+O2(g)为____反应(填“吸热”或“放热”)。