-
关于下列物质的用途的说法错误的是
A. 酚类化合物有毒,能用于杀菌消毒
B. 乙二醇可用于配制汽车防冻液
C. 烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
D. 甲醛的水溶液(福尔马林)可用于防腐
难度: 简单查看答案及解析
-
如图是四种常见有机物分子的比例模型示意图。下列说法正确的是( )
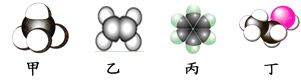
A.甲是甲烷,甲烷的二氯取代产物只有一种结构
B.乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色
C.丙是苯,苯结构比较稳定,不能发生氧化反应
D.丁是乙酸,一定条件下乙酸能跟乙醇发生酯化反应
难度: 简单查看答案及解析
-
下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃的条件下ΔH不相同
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下都能发生
D.化学反应的反应热可通过反应物的键能之和减去生成物的键能之和求得
难度: 简单查看答案及解析
-
已知反应A2(g)+2B(s)⇌A2B2(g)△H<0,下列说法正确的是( )
A.升高温度,正反应速率减慢,逆反应速率加快,化学平衡向逆反应方向移动
B.增大压强,正反应与逆反应速率均增大,平衡不移动
C.增大A2(g)的浓度,化学平衡向正反应方向移动,A2的转化率增大
D.增大B的物质的量,化学平衡向正反应方向移动,A2的转化率增大
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
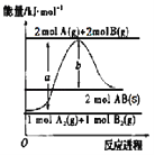
A.该反应热△H=+(a﹣b)kJ•mol﹣1
B.AB(g)═A2(g)+B2(g)△H=+b/2kJ•mol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A. 向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成
B. 将AlCl3固体溶解于盛有适量蒸馏水的烧杯中,再经转移、洗涤、定容和摇匀就可以在容量瓶中配制成一定浓度的AlCl3溶液
C. 向2mL2%的CuSO4溶液中加A的0.5mL1%NaOH溶液,振荡后滴加几滴M溶液加热,未出现红色沉淀,不能说明M中不含醛基
D. 过氧化钠是强氧化剂,能氧化二氧化碳,可以在呼吸面具中作为氧气的来源
难度: 中等查看答案及解析
-
下列说法正确的是
A.H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D.已知:298K时,N2(g)+3H2(g)
 2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量难度: 中等查看答案及解析
-
在容积为2L的密闭容器中发生反应xA(g)+yB(g)⇌zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
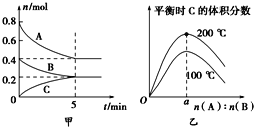
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2
难度: 中等查看答案及解析
-
常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
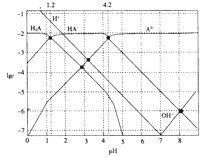
下列说法不正确的是
A. H2A是二元弱酸
B. HA-
 H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B.将CH3COONa溶液从20℃升温至60℃,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
难度: 中等查看答案及解析
-
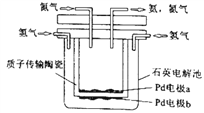
下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3
 Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是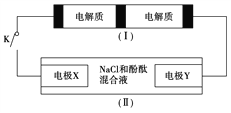
A. 闭合开关K时,Na+从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+
C. 闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
D. 闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑
难度: 中等查看答案及解析
-
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移2 mol电子
C.电解得到铜的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol/L
难度: 中等查看答案及解析
-
下列说法正确的是
A.1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯
B.对苯二甲酸(
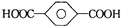 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(
)与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(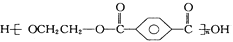 )
)C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种
D.
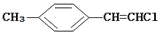 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面难度: 中等查看答案及解析
-
科学家研制的一种使沙漠变绿洲的新技术,即在沙漠中喷洒一定量的聚丙烯酸酯
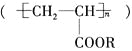 与水的混合物,使其与沙粒结合,形成既能阻止地下的盐分上升,又能拦截、蓄积雨水的作用。下列对聚丙烯酸酯的叙述中正确的是( )
与水的混合物,使其与沙粒结合,形成既能阻止地下的盐分上升,又能拦截、蓄积雨水的作用。下列对聚丙烯酸酯的叙述中正确的是( )①聚丙烯酸酯的单体的结构简式为CH2=CHCOOR
②聚丙烯酸酯没有固定的熔、沸点
③聚丙烯酸酯能发生加成反应
④合成聚丙烯酸酯的反应属于缩聚反应
A.③④ B.①②
C.①②③ D.①②③④
难度: 中等查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)
 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )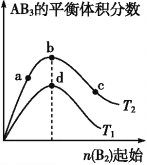
A.图中T2一定大于T1
B.图中b点速率一定大于d点速率
C.达到平衡时,A2的转化率大小为c>b>a
D.加入催化剂可以使状态d变为状态b
难度: 困难查看答案及解析
-
为探究外界条件对反应:mA(g)+nB(g)⇌cZ(g) ΔH 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
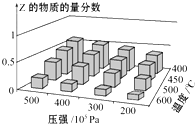
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.ΔH>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
难度: 中等查看答案及解析

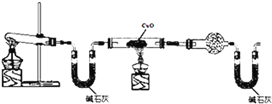
 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)