-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项
X
Y
A
SO2
H2S
B
Cl2
CO2
C
NH3
CO2
D
SO2
Cl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中。常温下Z单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )
A.最简单氢化物的沸点:Y>W
B.元素Y的最高化合价为+6价
C.原子半径的大小顺序:W>Z>X>Y
D.X、Z、W分别与Y均能形成多种二元化合物
难度: 中等查看答案及解析
-
化学是人类进步的阶梯。下列有关说法不正确的是
A.发展“低碳经济”,减少化石燃料的使用,能够减少温室效应
B.大力发展铅、汞等蓄电池的生产,改变能源结构,有利于保护环境
C.各种新型复合材料的使用,促进了我国高铁性能的提升
D.研制开发高效催化剂,提高水光解的反应速率,有利于开发氢能源
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.中子数为20的硫原子:
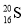 B.Na的结构示意图:
B.Na的结构示意图: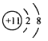
C.Na2S的电子式:
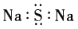 D.二氧化碳的结构式:O=C=O
D.二氧化碳的结构式:O=C=O难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.lmol•L-1NaHCO3溶液:Na+、Ba2+、
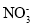 、OH-
、OH-B.0.lmol•L-1NaAlO2溶液:K+、OH-、Cl-、
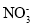
C.无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、
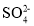 、S2-、Cl-
、S2-、Cl-难度: 困难查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列说法中不正确的是
A.1molCl2与足量的NaOH溶液充分反应,转移电子的数目小于2NA
B.120gNaHSO4固体中含有的阳离子数为NA
C.lLpH=3.0的草酸溶液含有H+数目为0.00lNA
D.22.4L氨气完全溶于水中,所得溶液中NH3•H2O和
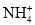 微粒数目之和为NA
微粒数目之和为NA难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.用稀硝酸洗涤试管内壁的银镜:Ag+4H++
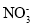 =Ag++NO↑+2H2O
=Ag++NO↑+2H2OB.向MgCl2溶液中滴加过量氨水:Mg2++2OH-=Mg(OH)2↓
C.NO2溶于水:3NO2+H2O=2H++2
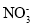 +NO
+NOD.将Cu粉加入Fe2(SO4)3溶液中:2Fe3++3Cu=2Fe+3Cu2+
难度: 中等查看答案及解析
-
在离子方程式xR2++yH++O2=mR3++nH2O中,下列判断错误的是
A.m=4 R2+是还原剂 B.m=y R3+是氧化产物
C.m=2 R2+是还原剂 D.m=y H2O是还原产物
难度: 中等查看答案及解析
-
下列实验现象和结论均正确,且有因果关系的是
选项
实验操作
实验现象
实验结论
A
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
B
测定同温同浓度的Na2CO3和Na2SO3溶液的pH
前者pH大于后者
S的非金属性比C强
C
将湿润的石蕊试纸伸入到甲烷与氯气在光照条件下反应后的混合气体中
石蕊试纸变红
生成的氯甲烷具有酸性
D
向lmL0.1mol·L-1MgSO4溶液中,滴入2滴0.lmol•L-1NaOH溶液,再滴入2滴0.1mol·L-1CuSO4溶液
开始有白色沉淀生成,后白色沉淀逐渐变为蓝色
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A.
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C.
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
知识的迁移应用是高中化学重要的思维方法,下列各有关说法中合理的是
A.Cl、I位于同一主族,铁与氯气反应生成FeCl3,则与I2反应也生成FeI3
B.锌能置换铜,则将钠置于硫酸铜溶液中可见红色固体析出
C.乙烯能使酸性高锰酸钾溶液褪色,苯也能使酸性高锰酸钾溶液褪色
D.二糖在一定条件下能发生水解反应,则多糖在一定条件下也能水解
难度: 中等查看答案及解析
-
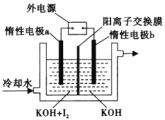
如图为一氧化碳气体传感器工作原理示意图。图中电流方向已示。电极A、B外覆盖一层聚四氟乙烯纳米纤维膜,可以让气体透过。下列相关叙述,正确的是
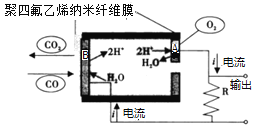
A.该传感器运用了原电池原理,正极反应为CO-2e-+H2O=CO2+2H+
B.当外电路中流过0.002mol电子时,电池正极消耗0.00lmol氧气
C.该传感器工作时,接触到的CO浓度增大,输出的电流强度也相应增大
D.给传感器充电时,传感器内部H+将由B极向A极迁移
难度: 困难查看答案及解析
-
氧化还原反应在工农业生产中有着广泛的应用,下列说法正确的是
A.铜铸雕像上出现铜绿[Cu2(OH)2CO3],说明铜具有还原性
B.SiO2+3C
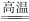 SiC+2CO↑的反应中,C是还原剂,SiO2是氧化剂
SiC+2CO↑的反应中,C是还原剂,SiO2是氧化剂C.NaC1O3和Na2SO3按物质的量比1:2完全反应,生成一种棕黄色气体一定是Cl2
D.由2S2Cl2+2H2O=4HCl+SO2↑+3S↓,知氧化产物与还原产物物质的量之比为3:1
难度: 中等查看答案及解析
-
药物瑞德西韦对新型冠状病毒(COVID—19)有明显抑制作用。有机物A是合成瑞德西韦的关键中间体,下列关于A的说法中正确的是
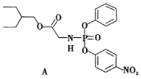
A.A的分子式为C20H26NO6P B.在一定条件下,A可以发生加成和取代反应
C.A中所有原子可能都在同一平面 D.A最多可以和8molH2加成
难度: 中等查看答案及解析
-
我国科学家研制了一种新型催化剂,可在阳光作用下将CO2转化为CO。下列叙述中不正确的是
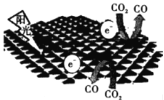
A.这一转化过程是将太阳能转化为化学能 B.该研究成果将在一定程度上有利于降低温室效应
C.该转变的总反应为2CO2
 2CO+O2 D.该新型催化剂可以改变CO2转化为CO反应的焓变
2CO+O2 D.该新型催化剂可以改变CO2转化为CO反应的焓变难度: 困难查看答案及解析
-
下列图示实验正确的是( )
A.制取蒸馏水
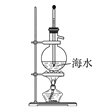
B.制取收集氨气
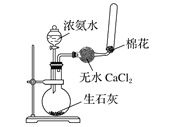
C.乙酸乙酯的制备
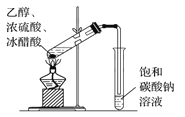
D.碳酸氢钠受热分解
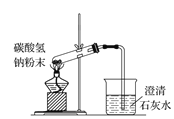
难度: 中等查看答案及解析
-
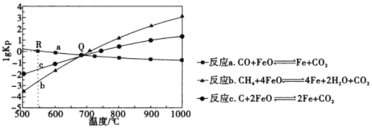
温度为T°C,向体积不等的密闭容器中分别加入足量活性炭和lmolNO2,发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示(V1<V2<V3)。下列说法正确的是
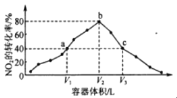
A.图中a点所示条件下v(正)=v(逆)
B.T°C时,a、b两点时反应的平衡常数Ka<Kb
C.向b点体系中充入一定量NO2,达到新平衡时,NO2转化率将增大
D.对c点容器加压,缩小容器体积,则此时v(逆)>v(正)
难度: 困难查看答案及解析
-
25°C时,用0.lmol/L的NaOH溶液,分别滴定20mL,浓度均为0.lmol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
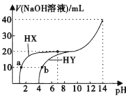
A.酸性:HX<HY B.溶液中水电离的程度:a点=b点
C.溶液b点溶液中,c(Na+)+c(H+)=c(Y-)+c(OH-) D.两种溶液中加入20mLNaOH溶液时,pH均为7
难度: 中等查看答案及解析
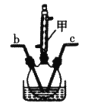
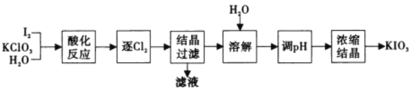
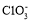 、
、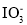 、I2 三者氧化性由强到弱的顺序是_______,“滤液”中的溶质主要是________,“逐 Cl2” 排出的Cl2 需用碱液吸收,该反应的离子方程式为_________,“调 pH ”中可选用的一种强碱为_________(填化学式)。
、I2 三者氧化性由强到弱的顺序是_______,“滤液”中的溶质主要是________,“逐 Cl2” 排出的Cl2 需用碱液吸收,该反应的离子方程式为_________,“调 pH ”中可选用的一种强碱为_________(填化学式)。