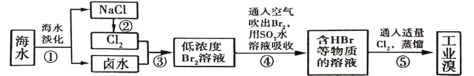
-
化学中存在一些守恒或平衡原理,下列叙述正确的是
A.根据质量(原子)守恒定律,某物质完全燃烧的产物是CO2和H2O则该物质一定是烃
B.根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C.根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D.根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
难度: 简单查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是
A.PVC(聚氯乙烯)包装袋不能用于食品包装
B.能生成有机高分子化合物的反应只有加聚反应
C.糖尿病人应少吃含糖的食品,即使是未加糖的八宝粥也要慎重食用
D.塑料、合成橡胶和合成纤维称为三大合成材料
难度: 简单查看答案及解析
-
下列变化过程中,属于放热反应的是
①碳和二氧化碳 ②黑火药爆炸 ③固体NaOH溶于水 ④钠与水反应 ⑤铝热反应 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌
A.①③⑥ B.②④⑤ C.②③④ D.②④⑥
难度: 简单查看答案及解析
-
下列化合物中只含共价键的是
A.KCl B.NaOH C.H2O D.MgCl2
难度: 简单查看答案及解析
-
为了说明影响化学反应快慢的因素,某同学分别设计了如下A~D四个实验,你认为结论不正确的是( )
A.将大小、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.氢氧根离子式:
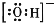 B.甲烷的球棍模型:
B.甲烷的球棍模型: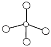
C.氯离子结构示意图:
 D.乙烯的结构简式:CH2CH2
D.乙烯的结构简式:CH2CH2难度: 简单查看答案及解析
-
月球表面土壤里有一种非常有用的资源
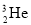 ,它是可控核聚变的原料,关于
,它是可控核聚变的原料,关于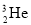 的叙述正确的是
的叙述正确的是A.
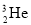 和
和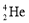 是同种原子
是同种原子B.
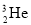 和
和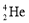 互为同位素
互为同位素C.核聚变时原子核发生了变化,所以发生了化学变化
D.在
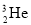 中存在:质子数=中子数=核外电子数
中存在:质子数=中子数=核外电子数难度: 简单查看答案及解析
-
联合国宣布2019年为“国际化学元素周期表年”,我国的刘庄教授为汞元素的代言人。下列关于
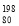 Hg的说法中,正确的是
Hg的说法中,正确的是A.质量数为278 B.中子数为118
C.质子数为198 D.中子数与核外电子数之差为80
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为20的元素位于元素周期表的第四周期ⅡA族
C.稀有气体元素原子的最外层电子数均为8
D.第ⅥA族元素的最高正价与最低负价的代数和都为4
难度: 简单查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,下列不合理的是
选项
事实
推测
A
Li与水能反应,Na与水反应剧烈
K与水反应更剧烈
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可以作半导体材料
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关有机物的说法中正确的是( )
A.
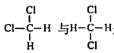 是同分异构体
是同分异构体B.乙醇、乙酸、乙烷都能发生取代反应
C.乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同
D.相同质量的CH4、C2H4、苯完全燃烧,耗氧量最小的是CH4
难度: 简单查看答案及解析
-
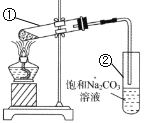
用排饱和食盐水的方法,按1:4比例在试管中收集甲烷和氯气的混合气体,光照一段时间。实验过程中不可能观察到的现象是( )
A.试管内气体颜色逐渐变浅 B.试管中有少量白雾
C.试管壁出现油状液滴 D.试管内液面上升,一段时间后水充满整个试管
难度: 简单查看答案及解析
-
有关煤、石油和天然气的综合利用,下列说法正确的是
A.水煤气主要成分是CH4
B.煤的气化和液化、石油的分馏都是物理变化
C.裂解的目的是提高汽油的产量和质量
D.鉴别直馏汽油和裂化汽油,可用KMnO4溶液鉴别
难度: 简单查看答案及解析
-
下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
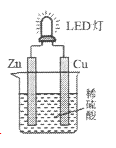
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理,错误的是( )。
A.2NaCl(熔融)
 2Na+Cl2↑
2Na+Cl2↑B.MgO+H2
 Mg+H2O
Mg+H2OC.Fe3O4+4CO
 3Fe+4CO2
3Fe+4CO2D.2HgO
 2Hg+O2↑
2Hg+O2↑难度: 简单查看答案及解析
-
在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生反应:2SO2(g)+O2(g)
 2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是
2SO3(g) ΔH=-197kJ/mol,下列说法中正确的是A.为提高SO2转化率,可以再加入SO2 B.平衡时放出197kJ热量
C.平衡时再充入O2,则v正增大,v逆减小 D.平衡时SO2和SO3共2mol
难度: 中等查看答案及解析
-
有关卤族和碱金属元素性质的递变规律说法正确的是
A.卤族元素从F到I,对应氢化物的还原性逐渐增强
B.碱金属元素与O2反应均可得到多种氧化物
C.碱金属元素从Li到Cs,熔沸点逐渐升高
D.卤素单质从F2→I2氧化性逐渐增强
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.任何化学反应都伴随着能量的变化
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.化学反应中的能量变化都是以热量的形式体现
D.2CO(g)+O2(g)=2CO2(g)△H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量
难度: 中等查看答案及解析
-
对于可逆反应H2(g)+I2(g)
 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.正、逆反应速率的比值是恒定的
C.达到平衡时,正、逆反应速率相等
D.达到平衡时,H2(g)和I2(g)浓度不在变化且相等
难度: 简单查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如图,Y的氧化物随意排放易形成酸雨,下列说法不正确的是:
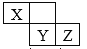
A.化合物XZ3分子中只存在极性共价键
B.X、Y、Z三种元素分别形成的含氧酸不一定都是强酸
C.因为非金属性Z>Y,所以水溶液中酸性HZ>H2Y
D.X的最高价氧化物对应的水化物和X的简单氢化物能形成盐
难度: 中等查看答案及解析
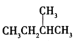 与
与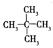 ;F.葡萄糖与果糖;G.蔗糖与麦芽糖
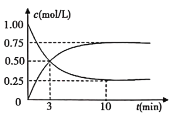
;F.葡萄糖与果糖;G.蔗糖与麦芽糖 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: