-
化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是
A.生活中常用的塑料制品及橡胶制品都为高分子材料
B.埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的
C.明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同
D.离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了相关的化学知识,古化文献中充分记载了古代化学研究成果。下列关于古代化学的应用和记载,对其说明不合理的是
A.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了“KNO3的氧化性”
B.李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
C.《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”。
D.我国古代人民常用明矾水除去铜器上的铜锈〔Cu2(OH)2CO3〕
难度: 简单查看答案及解析
-
下列有关有机物的说法正确的是
A.C8H10含苯环的烃同分异构体有3种
B.丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物
C.油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
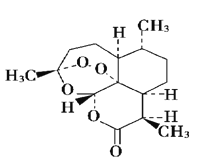
D.青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取, 能够发生水解反应,具有强氧化性
难度: 中等查看答案及解析
-
已知A为常见温室气体,B 为淡黄色氧化物,C 为常见液体,D 为黄绿色气体单质,相互反应的关系如右图所示,M 的水溶液能杀菌消毒。下列有关叙述正确的是
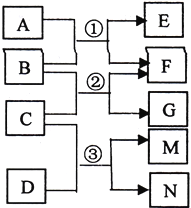
A.4.4gA 含有4.4NA个质子
B.7.8g B 与足量A 发生反应①,共转移0.2NA 电子
C.反应③的离子方程式为:Cl2+H2O
 2H++Cl-+ ClO-
2H++Cl-+ ClO-D.M 的电子式为:
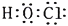
难度: 中等查看答案及解析
-
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
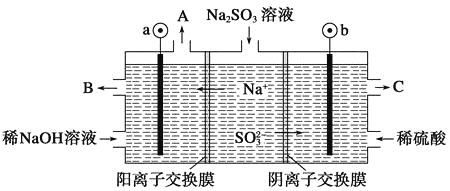
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
难度: 困难查看答案及解析
-
甲、乙、丙、丁分别为A、B、C、D 四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH 与A、C、D 的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是( )
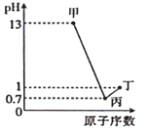
A.简单离子半径: D>C>B>A
B.A、C形成的化合物水溶液呈碱性
C.C、D形成的氢化物稳定性:C>D
D.A、B 分别与D 形成的化合物均为离子化合物
难度: 困难查看答案及解析
-
在25℃时,将1.0 L w mol·L-1 CH3COOH 溶液与0.1 mol NaOH固体混合,充分反应。向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH随加入CH3COOH或CH3COONa固体的物质的量的变化关系如图所示。下列叙述正确的是
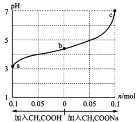
A.b点混合液中c(H+)≥ c(OH-) + c(CH3COO-)
B.加入CH3COOH过程中,
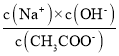 增大
增大C.25℃时,CH3COOH的电离平衡常数 Ka=
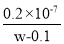 mol·L-1
mol·L-1D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
难度: 困难查看答案及解析
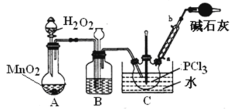
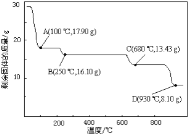
 2NO(g)
2NO(g) +NO
+NO +_____=Mn2++NO
+_____=Mn2++NO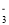 +H2O。
+H2O。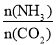 = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。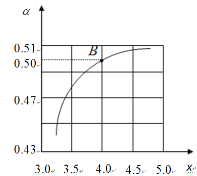
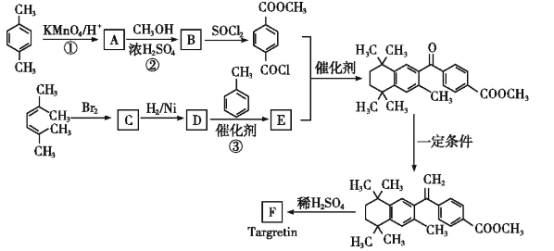
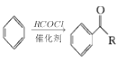
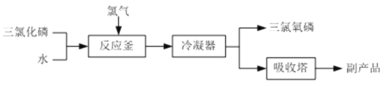
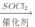 RCOCl(R表示烃基)
RCOCl(R表示烃基)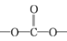 结构):__。
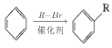
结构):__。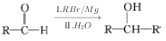 (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成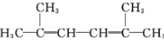 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。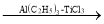
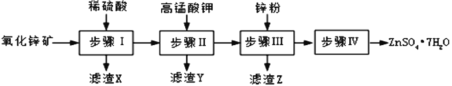
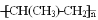 ,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。