-
垃圾分类并回收利用,可以节约自然资源,符合可持续发展的要求。与废旧镍镉电池、过期药品对应的垃圾分类标志是( )
A.
 B.
B.
C.
 D.
D.
难度: 简单查看答案及解析
-
下列物质中,属于弱电解质的是( )
A.H2O B.H2SO4 C.Cu D.BaSO4
难度: 简单查看答案及解析
-
下列关于反应2SO2(g)+O2(g)⇌2SO3(g)的描述正确的是( )
A.使用催化剂,SO2的平衡转化率增大
B.增大O2浓度,平衡常数K增大
C.当2
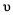 正(SO2)=
正(SO2)=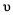 逆(O2)时,反应达到平衡状态
逆(O2)时,反应达到平衡状态D.升高温度,反应物中活化分子百分数提高,反应速率增大
难度: 简单查看答案及解析
-
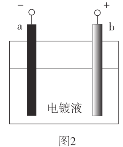
锌铜原电池裝置如图所示,下列说法不正确的是( )
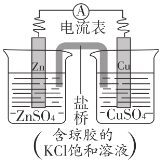
A.锌电极上发生反应:Zn-2e-=Zn2+
B.电子从锌片流向铜片
C.盐桥中K+移向ZnSO4溶液
D.理论上,当6.5gZn溶解时析出6.4gCu
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.100mL1mol/LAl2(SO4)3溶液中,所含Al3+的数目为0.2NA
B.100mL1mol/L氨水中,所含NH
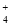 的数目为0.1NA
的数目为0.1NAC.将1molN2和3molH2充入密闭容器,一定条件下充分反应,得到2NA个NH3分子
D.已知2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,若反应放出242kJ热量,则形成2NA个共价键
难度: 中等查看答案及解析
-
一种NO催化氧化的过程如图所示:
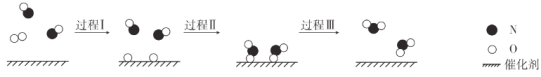
下列说法不正确的是( )
A.过程Ⅰ需要吸收能量
B.过程Ⅱ表示NO和O2生成具有极性共价键的NO2
C.催化剂能降低反应的活化能,从而加快反应速率
D.上述过程总反应的化学方程式是2NO+O2
 2NO2
2NO2难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是( )
A.将装有NO2的玻璃球浸入热水中颜色加深:2NO2(g)
 N2O4(g) ΔH>0
N2O4(g) ΔH>0B.用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
C.Na2S2O3溶液与稀H2SO4混合产生浑浊:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
D.闪锌矿(ZnS)经CuSO4溶液作用转变为铜蓝(CuS):ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
难度: 中等查看答案及解析
-
下列实验方案不能达到相应目的的是( )
目的
A.验证牺牲阳极的阴极保护法
B.研究浓度对FeCl3水解平衡的影响
实验方案
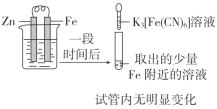

目的
C.比较CH3COOH和H3BO3(硼酸)酸性的强弱
D.比较AgCl和AgI溶解度的大小
实验方案
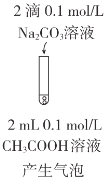
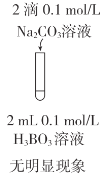
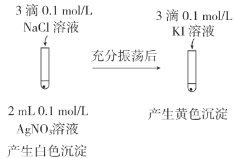
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置
实验数据
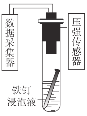
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
难度: 中等查看答案及解析
-
根据下图所得判断正确的是( )
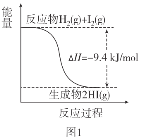
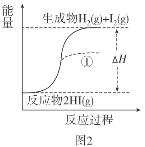
已知:I2(g)=I2(s) ΔH=-62.4kJ/mol
A.图1反应为吸热反应
B.图2反应的热化学方程式为2HI(g)
 H2(g)+I2(g) ΔH=+9.4kJ/mol
H2(g)+I2(g) ΔH=+9.4kJ/molC.图2中若I2的状态为固态,则能量变化曲线可能为①
D.断裂1molH2(g)和1molI2(g)中化学键需要的能量大于断裂2molHI(g)中化学键需要的能量
难度: 困难查看答案及解析
-
利用太阳能光伏电池电解水获得H2,工作示意图如图。下列分析不正确的是( )
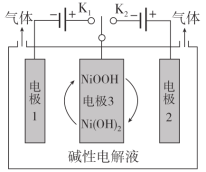
A.控制开关连接K1,电极1发生反应:2H2O+2e-=H2↑+2OH-
B.控制开关连接K2,电极3附近溶液的pH减小
C.通过控制开关连接K1或K2,可交替得到H2和O2
D.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化实现电子转移
难度: 中等查看答案及解析
-
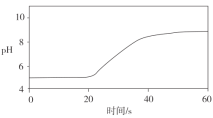
常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
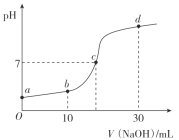
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
难度: 中等查看答案及解析
-
羰基硫(COS)可用作粮食熏蒸剂,可由CO和H2S在一定条件下反应制得。在2L的密闭容器中发生反应CO(g)+H2S(g)
 COS(g)+H2(g),有关数据如表所示:
COS(g)+H2(g),有关数据如表所示:实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(CO)
n(H2S)
n(CO)
①
150
10
10
7
②
400
20
20
16
下列说法正确的是( )
A.②中CO的平衡转化率为80%
B.400℃时该反应的平衡常数K=
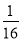
C.该反应是吸热反应
D.①中反应10min达到平衡,0~10min的平均反应速率:v(CO)=0.3mol/(L•min)
难度: 困难查看答案及解析
-
某小组同学电解CuCl2溶液(电极均为石墨),实验如下:
实验
电压/V
c(CuCl2)/(mol/L)
阴极现象
阳极现象
①
a
0.5
电极表面析出红色固体
产生气泡
②
a
2.0
电极表面析出白色固体(经检验为CuCl)
产生气泡(比①快)
③
b
0.5
电极表面析出红色固体,一段时间后产生气泡
产生气泡(比①快)
下列说法不正确的是( )
A.①中析出红色固体的电极反应式:Cu2++2e-=Cu
B.③中阴极产生的气体能使湿润的淀粉碘化钾试纸变蓝
C.对比①③,推测电压a<b
D.对比①②,推测电压为aV时电解1.0mol/LCuCl2溶液,阴极会析出红色和白色固体
难度: 中等查看答案及解析

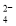 、Ni2++2H2O⇌Ni(OH)2+2H+
、Ni2++2H2O⇌Ni(OH)2+2H+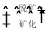 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO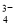 (aq)+OH-(aq)
(aq)+OH-(aq)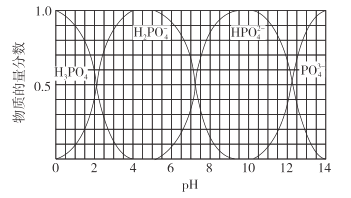
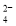 的水解程度大于其电离程度
的水解程度大于其电离程度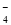 )+2c(HPO
)+2c(HPO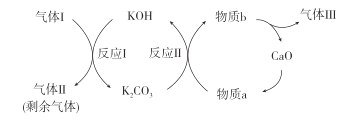
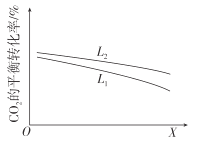
 CO(g)+H2O(g)
CO(g)+H2O(g)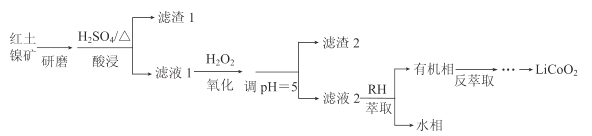
 CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)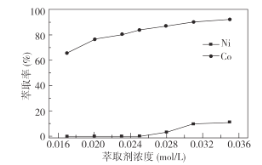
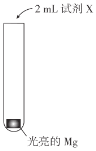
 溶解Mg(OH)2固体,使Mg能够持续与水反应。
溶解Mg(OH)2固体,使Mg能够持续与水反应。