-
化学与生产、生活、环境密切相关下列说法正确的是
A.95%的乙醇能有效杀死新型冠状病毒
B.某些金属元素的焰色反应、海水提溴、海水提碘都是化学变化
C.氮氧化物的大量排放会导致光化学烟雾、酸雨和温室效应等环境问题
D.白葡萄酒含维生素C等多种维生素,添加微量SO2可防止其被氧化
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是
A.中子数为117、质子数为78的铂原子:
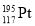
B.二氧化碳的电子式:
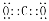
C.氯离子的结构示意图:
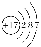
D.NH5的结构与NH4Cl相似,则NH5的结构示意图为:
难度: 中等查看答案及解析
-
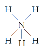
LiH、LiD、LiT在一定条件下都可产生极高的能量,被广泛应用在火箭推进剂和核反应中。下列有关说法正确的是
A.LiH、LiD、LiT互称同位素
B.H、D、T的化学性质不同
C.H、D、T之间的转化是化学变化
D.LiH、LiD、LiT中氢元素的化合价均为-1价,因此在反应中常做还原剂
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A.7.8gNa2O2固体中含有的阴离子数是0.1NA
B.0.1mol·L-1的Ba(OH)2溶液中含有的OH-数为0.2NA
C.常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA
D.0.1molN2与0.3molH2在密闭容器中充分反应,可生成0.6NA个N-H键
难度: 中等查看答案及解析
-
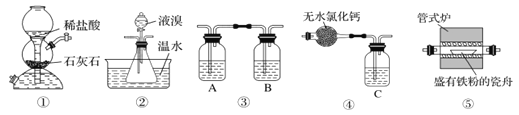
下列利用相关实验仪器能够完成相应实验的是
选项
实验仪器
相应实验
A
250mL容量瓶、烧杯、玻璃棒、托盘天平
配制250mL0.3mol·L-1NaCl溶液
B
三脚架、坩埚、酒精灯、坩埚钳、泥三角
从食盐水中得到NaCl晶体
C
分液漏斗、烧杯、铁架台、玻璃棒
用CCl4萃取溴水中的Br2
D
酒精灯、大试管、铁架台、铁夹
用碳酸氢铵固体制备氨气
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
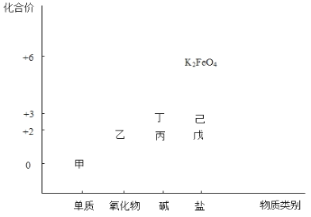
下列说法正确的组合是
①离子化合物中一定含有离子键,也可能含有共价键
②有化学键断裂的变化一定属于化学变化
③含金属元素的化合物不一定是离子化合物
④由分子组成的物质中一定存在化学键
⑤熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.①③④ C.②③④ D.①②⑤
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.含有大量Fe3+的溶液:Na+、
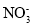 、Cl-、I-
、Cl-、I-B.透明溶液中:Cu2+、
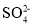 、Cl-、K+
、Cl-、K+C.0.1mol·L-1Fe(NO3)2溶液中:H+、Al3+、
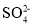 、Cl-
、Cl-D.c(H+)=1mol·L-1的溶液:
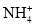 、Na+、
、Na+、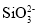 、CH3COO-
、CH3COO-难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A.Na与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
B.向次氯酸钙溶液中通入少量SO2(已知酸性H2SO3>HClO):Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
D.NH4HCO3溶液与足量NaOH溶液反应:HCO3-+OH-=CO32-+H2O
难度: 中等查看答案及解析
-
用下图所示的装置进行实验(夹持仪器略去),a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项
试剂1
试剂2
试剂3
实验目的
装置
A
浓盐酸
KMnO4
饱和NaCl溶液
制备干燥纯净的Cl2
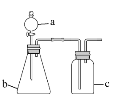
B
稀硫酸
NaHCO3
Na2SiO3溶液
验证非金属性:C>Si
C
稀硫酸
溶液X
澄淸石灰水
验证X中是否有
D
70%硫酸
Na2SO3
酸性KMnO4溶液
验证SO2具有漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
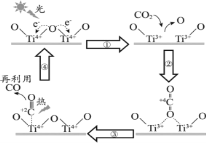
下图是CO与O在催化剂表面形成化学键的反应过程示意图,下列说法错误的是
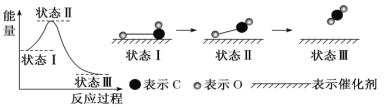
A.状态I→状态II需要吸收能量
B.状态I→状态III是放热过程
C.整个过程中既有旧键的断裂又有新键的形成
D.状态I对应物质的稳定性低于状态III对应的物质
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键和共价键的断裂和形成的是
A.3NO2+H2O==2HNO3+NO
B.2Na2O2+2H2O==4NaOH+O2↑
C.8NH3+3Cl2==6NH4Cl+N2
D.2NH3+CO2+H2O==(NH4)2CO3
难度: 简单查看答案及解析
-
短周期主族元素R、X、Y、Z、W在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍,下列推断正确的是
R
X
Y
Z
W
A.原子半径由小到大的顺序:X<Y<W<Z
B.气态氢化物的热稳定性由强到弱的顺序:Y>X>Z>R
C.最高价氧化物对应水化物的酸性由弱到强的顺序:Z<R<W
D.RY3、ZW5分子中每个原子最外层都达到8电子结构
难度: 中等查看答案及解析
-
自热食品无需火电,将水倒在发热包上即可加热食物。发热包的主要成分是:铁粉、铝粉、焦炭粉、活性炭、生石灰、碳酸钠、焙烧硅藻土等,下列说法错误的是
A.生石灰和水反应放出热量
B.发热包用后所得产物的碱性增强
C.发热包用后的产物不环保,冷却后要进行回收处理
D.反应过程中有微小原电池形成,负极反应为:Fe-3e-==Fe3+
难度: 简单查看答案及解析
-
下列措施对改变反应速率的影响正确的是
A.Al与NaOH溶液反应,将Al片改成Al粉会加快反应速率
B.CaCO3与稀盐酸反应,加入NaCl溶液,不会改变反应速率
C.K2SO4溶液与BaCl2溶液反应,加入KCl固体,将加快反应速率
D.Zn与稀硫酸反应制取H2,改用98%的浓硫酸将加快H2的生成速率
难度: 简单查看答案及解析
-
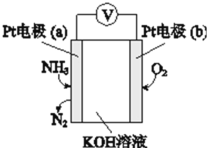
用如图所示装置探究原电池的工作原理,下列说法错误的是
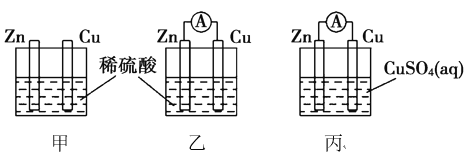
A.甲图中锌片质量减轻,铜棒上有气体产生
B.乙图中正极上发生的反应为:2H++2e-==H2↑
C.丙图中Zn片上发生氧化反应,溶液中的Cu2+向铜电极移动
D.若乙图与丙图中锌片减轻的质量相等,则两装置中还原产物的质量比为1∶32
难度: 中等查看答案及解析
-
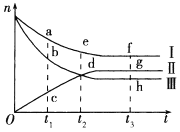
一定温度下,向2L密闭容器中加入足量C(s)并充入2molH2O(g),发生反应C(s)+H2O(g)
 CO(g)+H2(g),反应过程中测得如下数据,下列说法错误的是
CO(g)+H2(g),反应过程中测得如下数据,下列说法错误的是t/min
0
2
4
6
8
10
n(H2)/mol
0
0.8
1.4
1.8
1.8
……
A.6min时,反应达到平衡状态,各组分的物质的量均不再改变
B.6min~8min时间段内,υ(H2)=0mol·L-1·min-1
C.该条件下,无论反应多长时间,c(H2)<1mol·L-1
D.保持温度和体积不变,8min时向该容器中充入少量He(g),平衡将会发生移动
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是
A.
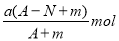
B.
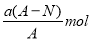
C.
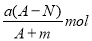
D.
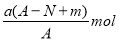
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①S
 SO3
SO3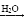 H2SO4
H2SO4②AlCl3溶液
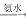 Al(OH)3
Al(OH)3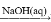 Na[Al(OH)4]
Na[Al(OH)4]③饱和NaCl溶液
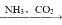 NaHCO3(s)
NaHCO3(s) Na2CO3(s)
Na2CO3(s)④Fe2O3(s)
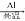 Fe(s)
Fe(s)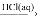 FeCl3(aq)
FeCl3(aq)⑤MgCl2(aq)
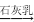 Mg(OH)2
Mg(OH)2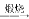 MgO(s)
MgO(s)A.①②③ B.②③⑤ C.②③④ D.②④⑤
难度: 中等查看答案及解析
-
含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、
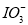 在一定条件下可发生如图转化关系,下列说法正确的是
在一定条件下可发生如图转化关系,下列说法正确的是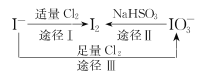
A.只用淀粉-KI试纸即可检验食盐中是否加碘
B.由图可知氧化性的强弱顺序为:
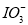 >Cl2>I2
>Cl2>I2C.生产等量的碘,途径I和途径II转移的电子数之比为5:2
D.途径III发生反应的离子方程式为:3Cl2+I-+3H2O=6Cl-+
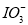 +6H+
+6H+难度: 中等查看答案及解析
-
将燃煤排放的含有SO2的烟气通入海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、
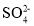 、Br-、
、Br-、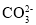 、
、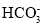 等离子)进行脱硫的工艺流程如图所示,下列说法错误的是
等离子)进行脱硫的工艺流程如图所示,下列说法错误的是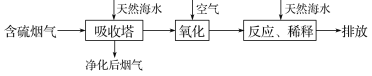
A.天然海水可能显弱碱性
B.“氧化”是利用氧气将H2SO3、
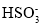 、
、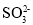 等氧化生成
等氧化生成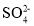
C.排入大海的溶液与天然海水相比,只有
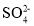 、Ca2+数量发生了变化
、Ca2+数量发生了变化D.若将氧化后的液体进行蒸发结晶,得到的晶体中NaCl含量最高
难度: 中等查看答案及解析