-
工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)( )
A.溴苯(溴):加NaOH溶液,分液
B.乙烷(乙烯):通入溴水,洗气
C.乙酸(水):加新制生石灰,蒸馏
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,分液
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.17g NH3中含有的电子数为8NA
B.1mol H2O2中含有极性键的数目为3NA
C.标准状况下,22.4L四氯化碳所含分子数为NA
D.28 g C2H4和C3H6的混合物中含有的碳原子数为2NA
难度: 中等查看答案及解析
-
下列各组物质含有的化学键类型完全相同的是:
A.NaOH、CaCl2、CaO B.Na2O、Na2O2、Na2S
C.NaCl、HCl、H2O D.HBr、CO2、NH3
难度: 简单查看答案及解析
-
在元素周期表中,从左到右共有18个纵行。第1纵行(氢除外)为碱金属元素,稀有气体是第18纵行。下列说法中正确的是
A.铝元素位于第3纵行 B.过渡元素在周期表中占10个纵行
C.第17纵行所有元素的化合价都有+7价 D.第16纵行元素都是非金属元素
难度: 简单查看答案及解析
-
下列实验操作的现象与对应结论均正确的是( )
选项
实验操作
现象
结论
A
将碘水倒入分液漏斗,加适量乙醇,振荡后静置
溶液分层,上层呈紫色
I2更易溶于有机溶剂
B
将铜片和M金属片用导线连接并插入MNO3的溶液中
铜片溶解
金属性:M>Cu
C
将一小块Na放入酒精中
有气泡产生
酒精中含有水
D
将石蜡油分解产生的气体通入到酸性高锰酸钾溶液中
溶液褪色
气体中含有烯烃
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
为证明无还原性的蔗糖水解后的生成物有还原性,可能有如下实验步骤:①加入稀硫酸;②加入几滴CuSO4溶液;③加热;④加入蒸馏水;⑤加入烧碱溶液至碱性;⑥加入新制Cu(OH)2悬浊液。最佳顺序是( )
A.④①③⑥③ B.④③①⑥⑤③
C.①③②⑥③ D.④①③⑤⑥③
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”共同获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有丙烯、戊醇、苯,下列说法不正确的是
A.苯与溴水混合会发生取代反应
B.丙烯能使溴水褪色
C.戊醇与乙醇都含有羟基
D.苯与足量氢气在镍催化作用下会发生加成反应生成环己烷
难度: 简单查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列化学用语表达正确的是
A.乙醇的结构简式:C2H6O B.氯离子的结构示意图:
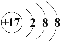
C.羟基的电子式:
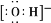 D.CH4分子的球棍模型:
D.CH4分子的球棍模型:
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
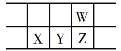
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用
 、、
、、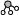 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )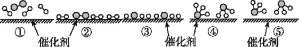
A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N2、H2 断键形成 N 原子和 H 原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
难度: 中等查看答案及解析
-
将FeCl3溶液和KI溶液混合,发生反应:2Fe3+(aq)+2I-(aq)
 2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是
2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是A.溶液颜色不再变化
B.c(K+)不再变化
C.c(Fe3+)与c(Fe2+)之和不再变化
D.v正(I-)=2v正(I2)
难度: 中等查看答案及解析
-
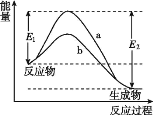
如图是化学反应中物质变化和能量变化的示意图。若 E1 > E2,则下列反应符合该示意图的是( )
A.NaOH 溶液与稀盐酸的反应 B.锌与稀盐酸的反应
C.碳酸钙受热分解的反应 D.一氧化碳在空气中的燃烧反应
难度: 简单查看答案及解析
-
某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
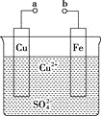
A. a和b不连接时,铁片上会有
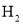 产生
产生B. a和b用导线连接时,铁片上发生的反应为
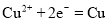
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
难度: 中等查看答案及解析
-
下列有关有机物的说法中正确的是( )
A.
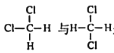 是同分异构体
是同分异构体B.乙醇、乙酸、乙烷都能发生取代反应
C.乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同
D.乙烷分子和乙烯分子都是立体结构
难度: 简单查看答案及解析
-
下列各组金属最适合用H2或CO把它从化合物中还原出来的是( )
A.Na、Mg B.Al、Fe C.Fe、Cu D.Hg、Ag
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是
A.除去乙醇中的乙酸
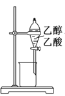 B.形成原电池
B.形成原电池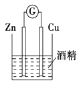
C.制取乙酸乙酯
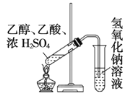 D.石油的分馏
D.石油的分馏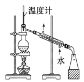
难度: 中等查看答案及解析
-
南极臭氧洞是指臭氧的浓度较臭氧洞发生前减少超过30%的区域,臭氧洞的形成与2O3
 3O2有关。下列叙述错误的是( )
3O2有关。下列叙述错误的是( )A.一定是化学变化 B.一定伴随着能量的变化
C.一定有共价键的断裂与生成 D.一定有电子的得失
难度: 简单查看答案及解析
-
某学生用如图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处降、乙处升,关于该反应的下列叙述中正确的是( )
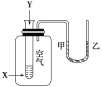
①该反应为放热反应
②该反应为吸热反应
③生成物的总能量比反应物的总能量更高
④反应物的总能量比生成物的总能量更高
⑤该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热能而释放出来
A.①③ B.①④ C.②③⑤ D.①④⑤
难度: 简单查看答案及解析
-
将CH4和C2H4的混合气体15 g通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积比为
A.1∶2 B.2∶1 C.3∶2 D.2∶3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.淀粉水解的最终产物都是氨基酸
B.纤维素不可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖的水解产物能发生银镜反应
难度: 简单查看答案及解析
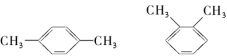 ② D 和 T ③ 甲烷(CH4)与丙烷(C3H8) ④ O2 与 O3⑤ H2O 和 H2O2⑥CH3CH2CH2CH3和
② D 和 T ③ 甲烷(CH4)与丙烷(C3H8) ④ O2 与 O3⑤ H2O 和 H2O2⑥CH3CH2CH2CH3和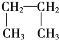
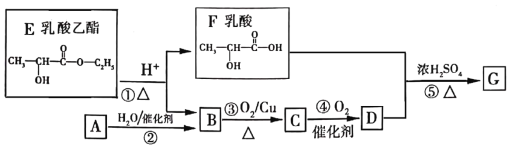
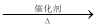 2CH3COOH
2CH3COOH