-
下列物质属于电解质的是( )
A.氨气 B.酒精 C.食盐水 D.氯化氢
难度: 简单查看答案及解析
-
下列防止钢铁腐蚀的方法不属于电化学防护的是( )
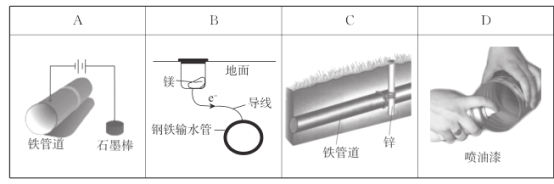
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.任何化学反应都会伴随着能量的变化
B.需要加热才能发生的反应一定是吸热反应
C.反应物的总能量大于生成物的总能量,则该反应为放热反应
D.断键吸收的总能最大于成键放出的总能量,则该反应为吸热反应
难度: 简单查看答案及解析
-
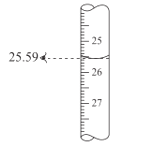
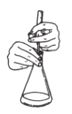
下列操作或仪器名称不正确的是( )
A.排出滴定管内气泡
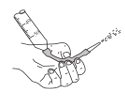
B.读取滴定管读数
C.锥形瓶
D.酸式滴定管无须用待测液润洗
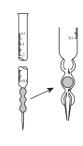
难度: 简单查看答案及解析
-
一定条件下,1mol氢气燃烧生成液态水,放出285.8kJ热量。下列热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(1) △H=-285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
D.2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ•mol-1
难度: 简单查看答案及解析
-
在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.SO2的转化率不再改变
B.容器内气体的质量不再改变
C.容器内的压强不再改变
D.SO3的生成速率与SO3的消耗速率相等
难度: 简单查看答案及解析
-
下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO
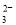
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO
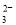 (aq)⇌CaCO3(s)+SO
(aq)⇌CaCO3(s)+SO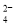 (aq)
(aq)难度: 简单查看答案及解析
-
下列溶液一定呈酸性的是( )
A.pH<7的溶液
B.c(H+)>c(OH-)的溶液
C.含有H+的溶液
D.由水电离出的c(H+)=10-6mol•L-1溶液
难度: 简单查看答案及解析
-
下列关于“有效碰撞”的说法不正确的是( )
A.分子间的碰撞均为有效碰撞
B.能发生化学反应的碰撞叫做有效碰撞
C.发生有效碰撞时,化学键才能断裂
D.其他条件相同时,反应物浓度越大,单位时间内的有效碰撞次数越多
难度: 简单查看答案及解析
-
25℃时,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1CH3COOH溶液,溶液的pH随加入NaOH溶液体积的变化如图。下列说法不正确的是( )
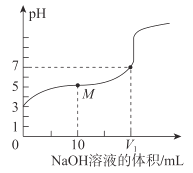
A.0.1mol•L-1CH3COOH溶液中,由水电离出的c(H+)<10-7mol•L-1
B.V1<20
C.M点溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.二者等体积混合时,c(Na+)=c(CH3COO-)+c(OH-)
难度: 中等查看答案及解析
-
按如图进行实验,探究H2O2的分解反应。
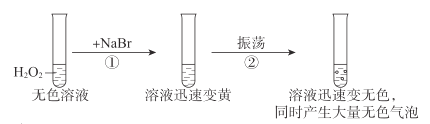
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
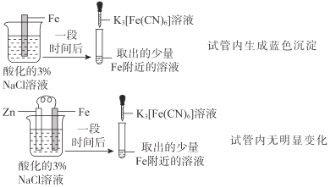
Zn保护了Fe不被腐蚀
B
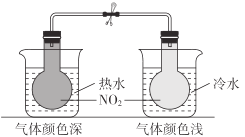
2NO2(g)⇌N2O4(g)为吸热反应
C

木炭与浓硝酸发生了反应
D

碳酸钠的水解程度强
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
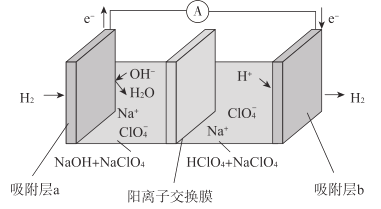
A.吸附层b为电池的正极
B.“全氢电池”的总反应为:H++OH-=H2O
C.NaClO4的作用是传导离子并参与电极反应
D.Na+在装置中从左侧透过阳离子交换膜向右侧移动
难度: 简单查看答案及解析
-
亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2质量计),某研究小组同学设计了如下实验方案:
I.称取样品Wg后加入足量稀硫酸;
II.将I中产生的SO2用足最H2O2溶液吸收;
III.将II所得溶液用0.lmol•L-1氢氧化钠溶液滴定,消耗体积为VmL;
IV.数据处理。
下列是小组同学对实验的设计、分析及数据处理,其中正确的是( )
A.步骤I中可用稀硝酸代替稀硫酸
B.1kg样品中含SO2的质量为
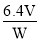 g
gC.若用”溴水”替换II中的氧化剂“H2O2溶液”,对测定结果无影响
D.步骤I中生成的SO2残留在装置中未被H2O2溶液吸收,可能导致测得亚硫酸盐含量偏低
难度: 中等查看答案及解析
 Li1-xCoO2+LixC6
Li1-xCoO2+LixC6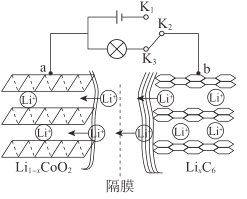
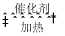 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)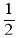 O2(g)=CuO(s)+Cl2(g) △H1=+63kJ∙mol-1
O2(g)=CuO(s)+Cl2(g) △H1=+63kJ∙mol-1
 Zn2++Cu
Zn2++Cu