-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中正确的是( )
A. X、M两种元素只能形成X2M型化合物
B. Y 的气态简单氢化物的热稳定性比W 的强
C. X2M、YM2中含有相同类型的化学键
D. 元素W和M的某些单质可作为水处理中的消毒剂
难度: 简单查看答案及解析
-
化学与生产生活息息相关,下列说法错误的是
A. 秸秆大量焚烧将产生雾霾
B. 由地沟油炼制的生物柴油属于烃类物质
C. “山东疫苗案”涉及的疫苗,因未冷藏储运而失效,这与蛋白质变性有关
D. 建设港珠澳大桥时采用超高分子量聚乙烯(UHMWPE)纤维吊绳,UHMWPE属于有机高分子化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 为防止富脂食品氧化变质,常在包装袋中放入生石灰
B. 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
C. 中国的瓷器驰名世界。我们日常生活中所用到的陶瓷,主要是硅酸盐产品
D. 为缓解旱情,可以用干冰或溴化银进行人工降雨
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.
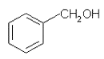 与
与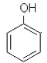 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物B.
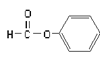 属于醛类,官能团为-CHO
属于醛类,官能团为-CHOC.
 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯D.
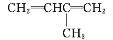 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯难度: 中等查看答案及解析
-
聚丙烯酸酯的结构简式可表示如图所示,可以由丙烯酸酯加聚得到。

下列关于聚丙烯酸酯的说法不正确的是
A. 属于高分子化合物
B. 聚丙烯酸酯属于混合物,没有固定的熔沸点
C. 单体为CH2=CH-COOR
D. 1mol分子中有n个碳碳双键。
难度: 简单查看答案及解析
-
下列有关同分异构体的说法正确的是
A.甲醇在铜催化和加热条件下生成的产物不存在同分异构体
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热,得到三种烯烃。
C.有机物
 的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。D.分子式为C5H10O2的有机物中含有
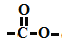 结构的同分异构体有12种
结构的同分异构体有12种难度: 困难查看答案及解析
-
下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO
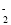 +2H2O
+2H2OB.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO
 =2Mn2++5SO
=2Mn2++5SO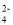 +4H+
+4H+C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O
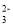 +6H+=2S↓+3H2O
+6H+=2S↓+3H2OD.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
难度: 中等查看答案及解析
-
下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO
 、SO
、SO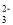
B.pH=12的溶液中:OH-、K+、Cl-、HCO

C.加入铝粉能放出氢气的溶液中一定存在:NH
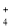 、NO
、NO 、AlO
、AlO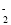 、SO
、SO
D.25ºC时pH=7的无色溶液中:Na+、Cl-、SO
 、K+
、K+难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
A.
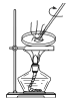 蒸发溴水获取溴单质
蒸发溴水获取溴单质B.
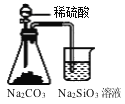 证明碳酸酸性强于硅酸
证明碳酸酸性强于硅酸C.
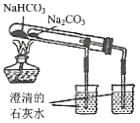 比较NaHCO3和Na2CO3的热稳定性
比较NaHCO3和Na2CO3的热稳定性D.
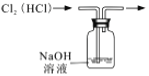 除去氯气中的HCl杂质
除去氯气中的HCl杂质难度: 中等查看答案及解析
-
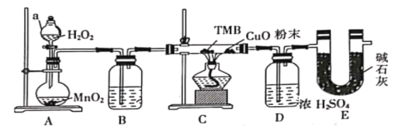
兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
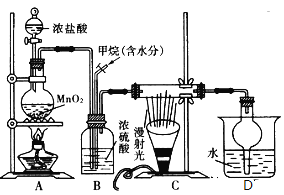
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.从D中分离出盐酸的方法为过滤
D.装置C经过一段时间的强光照射后,生成的有机物有4种
难度: 中等查看答案及解析
-
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
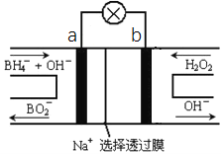
A.电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C.电池放电时Na+从b极区移向a极区
D.电极a采用MnO2,MnO2既作电极材料又有催化作用
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,下列说法正确的是
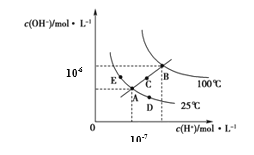
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
难度: 中等查看答案及解析
-
以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖 B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解 D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
难度: 中等查看答案及解析
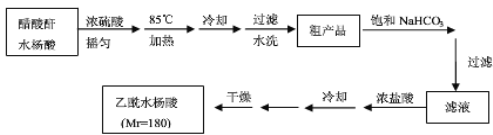
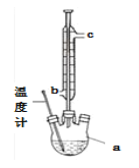
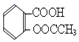 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为: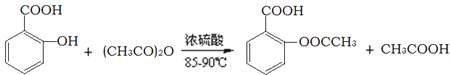
 CO(g)+H2O(g)
CO(g)+H2O(g) 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图: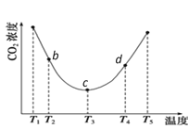
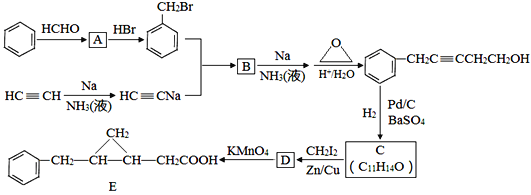

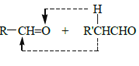

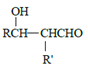
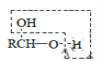
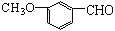
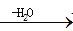 RCHO
RCHO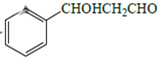 的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A B……
B……