-
已知下列元素的原子半径
元素
N
S
O
Si
原子半径/10-10m
0.75
1.02
0.74
1.17
根据以上数据,磷原子的半径可能是
A.1.10×10-10m B.1.20×10-10m C.0.80×10-10m D.0.70×10-10m
难度: 简单查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
难度: 中等查看答案及解析
-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
难度: 简单查看答案及解析
-
“垃圾是放错了位置的资源”。生活中废弃的铁锅、铝制易拉罐、铜导线等可以归为一类加以回收,它们属于
A.酸 B.碱 C.盐 D.金属或合金
难度: 简单查看答案及解析
-
食品安全警钟长鸣。近日,一批湖南大米中重金属元素镉超标事件被媒体广泛报导。下列有关镉(
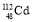 )的说法正确的是
)的说法正确的是A.原子序数为48 B.电子数为64 C.中子数为112 D.质量数为160
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A. 形成酸雨的主要物质是硫的氧化物和氮的氧化物
B. 大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气
C. 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D. 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
难度: 简单查看答案及解析
-
可以用来鉴别甲烷和乙烯两种气体的试剂是
A.乙醇 B.溴水 C.NaOH溶液 D.灼热的铜丝
难度: 简单查看答案及解析
-
下列有机物互为同分异构体的是
A.正丁烷和异丁烷 B.淀粉和纤维素
C.乙烯和聚乙烯 D.乙酸和乙醇
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法错误的是
A.过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA
B.48g正丁烷和10g异丁烷的混合物中共价键数目为l3NA
C.18gD2O和18gH2O中含有的质子数均为10NA
D.1molK2Cr2O7被还原为Cr3+转移的电子数为6NA
难度: 中等查看答案及解析
-
下列说法中错误的是
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质的燃烧可以看作为“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮气分子内部存在着很强的共价键,故通常情况下氮气的化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
难度: 中等查看答案及解析
-
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12 g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A.Q1<Q2
B.石墨不如金刚石稳定
C.石墨具有的能量比金刚石低
D.等质量的石墨与金刚石完全燃烧,生成的二氧化碳一样多
难度: 简单查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400~500℃下发生的催化氧化反应2SO2+O2
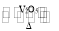 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是A.使用催化剂是为了加快反应速率,提高生产效率
B.达到平衡时,SO2的浓度与SO3的浓度相等
C.为了提高SO2的转化率,可适当提高O2的浓度
D.在上述条件下,SO2不可能100%地转化为SO3
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
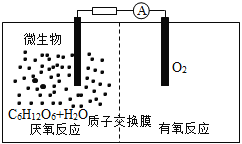
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
去年是门捷列夫发现元素周期表150周年,联合国将2019年定为“国际化学元素周期表年”,下列有关化学元素周期表的说法正确的是
A.第二周期主族元素的原子半径自左向右依次增大 B.ⅦA族元素的非金属性自上而下依次增强
C.主族元素均呈现与其族数相同的最高化合价 D.元素周期表共有18列
难度: 简单查看答案及解析
-
下列离子方程式能用来解释相应实验现象的是( )
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
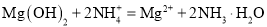
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
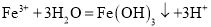
C
二氧化硫使酸性高锰酸钾溶液褪色
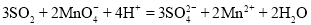
D
氧化亚铁溶于稀硝酸
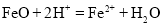
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是
A.18O2和16O2互为同位素
B.正己烷和2,2−二甲基丙烷互为同系物
C.C60和C70是具有相同质子数的不同核素
D.H2NCH2COOCH3和CH3CH2NO2是同分异构体
难度: 中等查看答案及解析
-
反应NH4Cl+NaNO2
 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是A.中子数为18的氯原子:
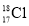
B.N2的结构式:N=N
C.Na+的结构示意图:
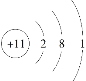
D.H2O的电子式:
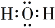
难度: 简单查看答案及解析
-
反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是
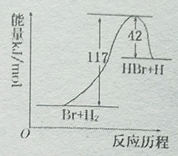
A.正反应为放热反应
B.正反应为吸热反应
C.加入催化剂,该反应吸收的能量增大
D.从图中可看出,该反应的能量变化为117 kJ/mol
难度: 简单查看答案及解析
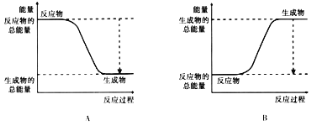
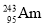 +
+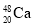 →288Mc+3
→288Mc+3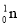 得到。该元素的质子数为_______,287Mc与288Mc互为________。
得到。该元素的质子数为_______,287Mc与288Mc互为________。