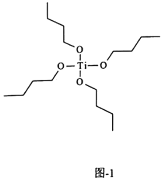
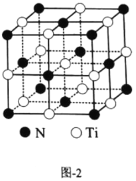
-
下列有关化学用语表示正确的是( )
A.
 的结构示意图:
的结构示意图: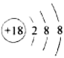 B.
B.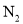 的电子式:
的电子式:
C.中子数为21的钾原子:
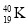 D.乙烯的结构简式:
D.乙烯的结构简式: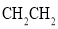
难度: 简单查看答案及解析
-
下列各组物质互为同分异构体的是( )
A.
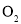 与
与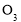 B.
B.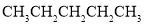 与
与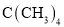
C.
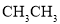 与
与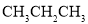 D.
D.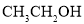 与
与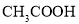
难度: 简单查看答案及解析
-
有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
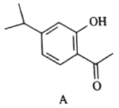
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.
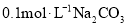 溶液:
溶液: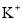 、
、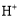 、
、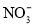 、
、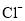
B.
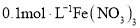 溶液:
溶液: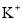 、
、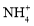 、
、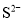 、
、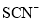
C.能使酚酞变红的溶液:
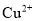 、
、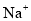 、
、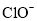 、
、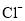
D.
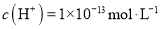 溶液中:
溶液中: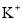 、
、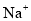 、
、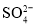 、
、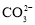
难度: 简单查看答案及解析
-
工业上用
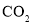 和
和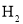 合成气态甲醇,反应方程式为
合成气态甲醇,反应方程式为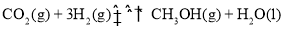
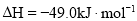 。下列说法正确的是( )
。下列说法正确的是( )A.使用催化剂能提高
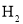 的平衡转化率
的平衡转化率B.充入足量的
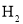 ,
,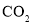 能100%转化为
能100%转化为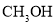
C.升高温度能加快该反应的速率
D.达到平衡时,反应速率:
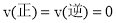
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向AlCl3溶液中滴加氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.大理石溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+H2O
D.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.氢氧燃料电池的负极反应为O2+2H2O+4e-=4OH-
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应
B.钢铁发生电化学腐蚀的负极反应式为:Fe-3e-=Fe3+
C.煤的燃烧需要加热点燃,故是吸热反应
D.放热反应中反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
H2A为二元弱酸。室温下,下列指定溶液中微粒物质的量浓度关系正确的是(忽略溶液混合引起的体积变化)( )
A.0.1mol/LH2A溶液:c(H2A)>c(HA-)>c(A2-)>c(H+)
B.0.1mol/LNaHA溶液(pH<7):c(Na+)>c(HA-);c(H2A)>c(A2-)
C.0.1mol/LNaHA溶液和0.1mol/LNaOH溶液等体积混合:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.0.1mol/LNaHA溶液(pH<7)和0.1mol/LH2A溶液等体积混合:c(Na+)>c(HA-)+2c(A2-)
难度: 中等查看答案及解析
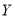 是一种药物合成中间体,可由化合物X制得。下列有关化合物X、Y的说法正确的是( )
是一种药物合成中间体,可由化合物X制得。下列有关化合物X、Y的说法正确的是( )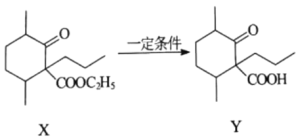
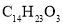
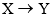 的反应类型为取代反应
的反应类型为取代反应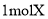 最多可与
最多可与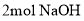 反应
反应 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)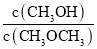 比容器Ⅱ中的大
比容器Ⅱ中的大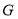 是某抗肿瘤药物的重要中间体,其部分合成路线如下:
是某抗肿瘤药物的重要中间体,其部分合成路线如下: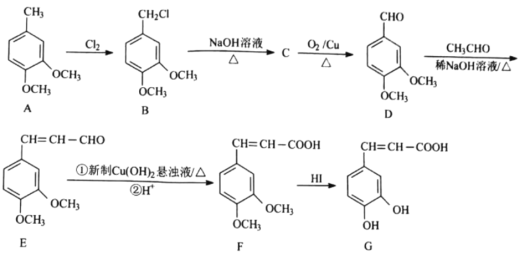
 中含氧官能团的名称为________和________。
中含氧官能团的名称为________和________。 的反应类型为________。
的反应类型为________。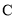 的结构简式为________。
的结构简式为________。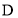 的一种同分异构体同时满足下列条件写出该同分异构体的结构简式:________。
的一种同分异构体同时满足下列条件写出该同分异构体的结构简式:________。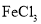 溶液发生显色反应;
溶液发生显色反应;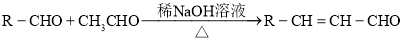
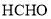 和
和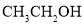 为原料制备
为原料制备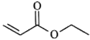 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。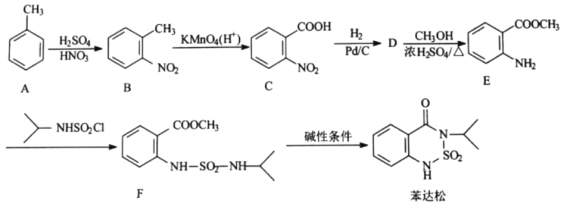
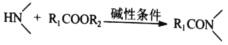
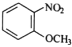 为原料制备
为原料制备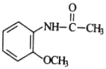 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)________。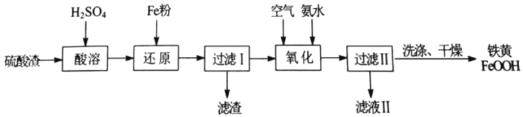
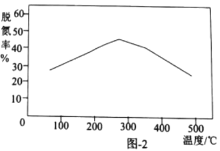
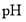 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。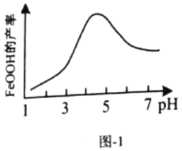
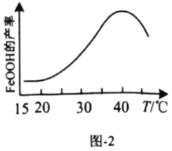
 2CO(g)+2H2(g)
2CO(g)+2H2(g)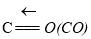
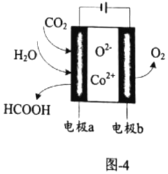
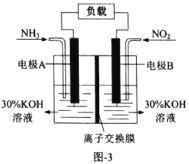
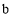 的电极反应式为________。
的电极反应式为________。