-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 能溶解Al2O3 的溶液:Na+、K+、HCO3-、NO3-
B. 0.1mol·L-1Ca(ClO)2 溶液:K+、Na+、I-、Cl-
C. 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
D. 加入KSCN 显红色的溶液:Na+、Mg2+、Cl-、SO42-
难度: 中等查看答案及解析
-
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A. 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B. 使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
D. 煤经过气化和液化生成了可燃性气体或液体,变为清洁能源,是化学变化
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 18O2—结构示意图:
B. 硝基苯的结构简式:
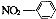
C. NaHSO4熔融时电离方程式:NaHSO4 == Na+ + HSO4-
D. CO2的比例模型:
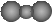
难度: 中等查看答案及解析
-
下列化工生产过程中,未涉及氧化还原反应的是
A. 海带提碘 B. 氯碱工业 C. 海水提溴 D. 侯氏制碱
难度: 中等查看答案及解析
-
下列实验现象可用同一原理解释的是
A. 溴水分别滴入植物油和裂化汽油中,溴水均褪色
B. 品红溶液中分别通入SO2和Cl2,品红均褪色
C. 鸡蛋白溶液中分别加入NaCl溶液和HgC12溶液,均有固体析出
D. 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
难度: 中等查看答案及解析
-
实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
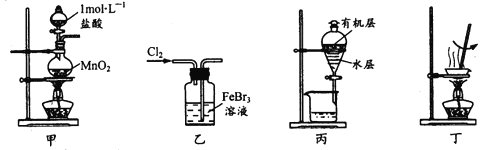
A. 用装置甲制取氯气
B. 用装置乙使Br- 全部转化为溴单质
C. 用装置丙分液时先从下口放出水层,再从上口倒出有机层
D. 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15, X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
C. XZ2, X2M2, W2Z2均为直线型的共价化合物
D. 由X元素形成的单质不一定是原子晶体
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO3−+I−+6H+=I2+3H2O
B. 用两个铜电极电解CuSO4 溶液:2Cu2+ +2H2O
 2Cu↓ + O2↑ +4H+
2Cu↓ + O2↑ +4H+C. 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:H++SO42-+Ba2++OH-= H2O+BaSO4↓
D. 向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:4Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2
 SiCl4
SiCl4 Si B. CuSO4
Si B. CuSO4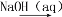 Cu(OH)2
Cu(OH)2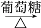 Cu
CuC. 饱和NaCl(aq)
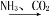 NaHCO3(s)
NaHCO3(s) Na2CO3(s) D. FeS2(s)
Na2CO3(s) D. FeS2(s)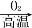 SO3(g)
SO3(g)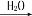 H2SO4
H2SO4难度: 简单查看答案及解析
-
铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)
 Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是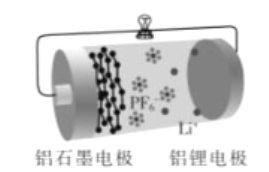
A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
难度: 中等查看答案及解析
-
化合物 Ⅲ 是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
 +HCl
+HCl下列有关叙述正确的是
A. I的分子式为C9H10O4
B. II中所有原子均有可能共面
C. 可用FeCl3溶液鉴别有机物I和III
D. 1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向NaI溶液中滴入少量新制氯水和苯,振荡、静置,溶液上层呈紫色
I-还原性强于Cl-
B
向某溶液中滴加H2O2溶液后再加入KSCN,溶液呈红色
溶液中一定含有Fe2+
C
将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液, 有白色沉淀产生
样品已变质
D
向蔗糖溶液中加入少量稀硫酸并加热,冷却,加入新制Cu(OH)2悬浊液,加热,未出现红色沉淀
蔗糖未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
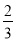 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示: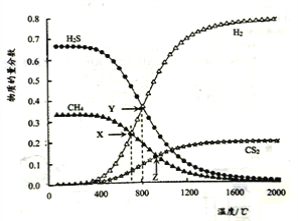
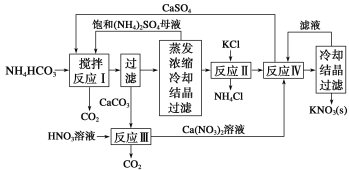
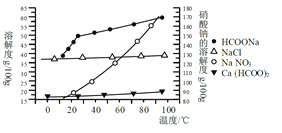

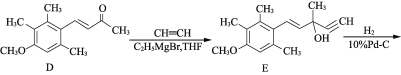
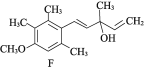
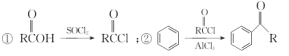 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。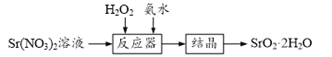
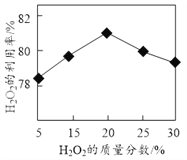
 S4O62-)
S4O62-)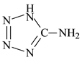 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。