-
化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述错误的是
A.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
B.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合会产生有毒的Cl2
C.过氧化钠可以用作呼吸面具的供氧剂,是因其可以和水、二氧化碳反应生成氧气
D.漂白粉在空气中久置变质,是因为其中的CaCl2与空气中的CO2反应生成CaCO3
难度: 简单查看答案及解析
-
下列科研成果不是由我国科学家发明或创造的是
A.结晶牛胰岛素的首次人工合成 B.青蒿素的发现与提取
C.元素周期律的发现 D.黑火药和造纸术
难度: 简单查看答案及解析
-
下列关于胶体的叙述错误的是
A.江河入海口三角洲的形成通常与胶体的性质有关
B.胶体不一定是液态,胶体的丁达尔效应属于化学变化
C.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
D.静电除尘器除去空气或工厂废气中的飘尘,利用的是胶粒带电荷的性质
难度: 简单查看答案及解析
-
下列反应既是置换反应又是氧化还原反应的是
A.2F2+2H2O== 4HF+O2 B.Cl2+H2O== HCl+HClO
C.3NO2+H2O== 2HNO3+ NO D.2Na2O2+2H2O== 4NaOH +O2↑
难度: 简单查看答案及解析
-
下列状态的物质既能导电,又属于电解质的是
A.熔融KCl B.NaOH溶液 C.NaCl晶体 D.液氯
难度: 简单查看答案及解析
-
下列物质的分类正确的是
选项
碱
酸
盐
碱性氧化物
酸性氧化物
A
NaOH
H2SO4
NaHCO3
Mn2O7
CO
B
Na2CO3
HClO
NaCl
Na2O
CO2
C
KOH
HNO3
CaCO3
CaO
SO2
D
Ba(OH)2
HCl
CaCl2
Na2O2
SO3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于氧化还原反应的说法错误的是
A.氧化还原反应中一定有电子转移
B.氧化剂与还原剂一定不是同一种物质
C.元素由化合态变成游离态时,可能被氧化,也可能被还原
D.氧化还原反应中,氧化剂发生还原反应,还原剂发生氧化反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法错误的是
A.1 mol·L-1 BaCl2溶液中含有的Ba2+离子数为NA
B.16 g O3与O2的混合气体中含有的氧原子数为NA
C.7.8g Na2O2与足量水反应,转移的电子数为0.1 NA
D.常温常压下,11.2 L氢气中含有的H2分子数小于0.5NA
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Cl2溶于水:Cl2+H2O== 2H++Cl-+ClO-
B.Na溶于水:2Na+2H2O == 2Na++2OH-+H2↑
C.CuO溶于稀硫酸:O2-+2H+== H2O
D.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+难度: 简单查看答案及解析
-
下列反应可用离子方程式“H++OH-== H2O”表示的是
A.H2SO4溶液与Ba(OH)2溶液混合 B.CH3COOH溶液与Ca(OH)2溶液混合
C.HNO3溶液与KOH溶液混合 D.NaHCO3溶液与NaOH溶液混合
难度: 简单查看答案及解析
-
下列有关钠、氯及其化合物的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.NaHCO3和Na2CO3均可用于制作膨松剂
C.用KI-淀粉溶液可检验Cl2中是否混有HCl
D.将Na 和Na2O2分别放入CuSO4溶液中,均会有蓝色沉淀生成并有无色气体放出
难度: 简单查看答案及解析
-
下列事实及其解释均正确的是
A.将石蕊试液滴入氯水中,溶液先变为蓝色后迅速褪色,说明氯水中有HClO存在
B.向氯水中加入NaOH溶液,氯水的浅黄绿色消失,说明氯水中有HClO存在
C.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2 与 H2O反应放热且有氧气生成
D.将钠长期暴露在空气中的产物是NaHCO3,原因是钠与氧气反应生成的Na2O与水和二氧化碳反应
难度: 中等查看答案及解析
-
利用如图所示装置进行金属钠与水反应的实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是
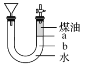
A.钠块始终保持在a处,直至完全消失
B.钠沉入U形管b处而后又慢慢浮到a处
C.最终钠块在煤油中燃烧起来
D.随反应的进行,煤油与胶塞处液面下降,漏斗中液面上升
难度: 中等查看答案及解析
-
某实验小组通过下图所示实验,探究Na2O2与水的反应:
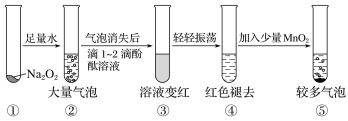
下列说法中正确的是
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
难度: 中等查看答案及解析
-
实验室既可用MnO2与浓盐酸在加热条件下反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法错误的是
A.KMnO4的氧化性比MnO2的强
B.上述两个反应中,浓盐酸均只体现还原性
C.制备等质量Cl2,消耗MnO2与KMnO4的物质的量比为5:2
D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol
难度: 中等查看答案及解析
-
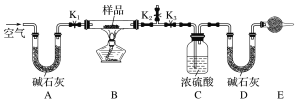
实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是
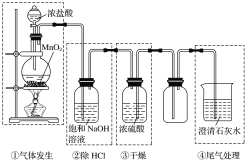
A.①②③ B.①②④ C.②③④ D.①③④
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液后,再进行如下操作,结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
产生白色沉淀
原溶液中有SO
B
滴加稀硫酸
有无色无味的气体产生
原溶液中有CO
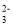
C
滴加盐酸酸化的BaCl2溶液
产生白色沉淀
原溶液中有SO
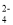
D
滴加硝酸酸化的AgNO3溶液
产生白色沉淀
原溶液中有Cl-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
为除去括号内的杂质,所选用的试剂或方法错误的是
A.CO2气体(HCl),饱和NaHCO3溶液
B.Na2CO3固体(NaHCO3),加热至不再产生气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
难度: 简单查看答案及解析
-
50 mL 0.3 mol·L-1Na2SO4溶液与100 mL 0.2 mol·L-1Fe2(SO4)3溶液混合后所得溶液中SO
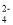 的物质的量浓度为(不考虑混合后溶液体积的变化)
的物质的量浓度为(不考虑混合后溶液体积的变化)A.0.5 mol·L-1 B.0.45 mol·L-1 C.0.4 mol·L-1 D.0.35 mol·L-1
难度: 简单查看答案及解析
-
在甲、乙、丙、丁四个烧杯中分别放入
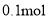 的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )
的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体全溶解,有甲、乙、丙、丁内溶液的溶质质量分数大小的顺序为( )A.甲<乙<丙<丁 B.丁<甲<乙=丙 C.甲=丁<乙=丙 D.丁<甲<乙<丙
难度: 中等查看答案及解析
 Na2CO3+10H2O↑。
Na2CO3+10H2O↑。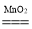 2H2O+O2↑
2H2O+O2↑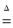 2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为________mol。
2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为________mol。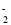 氧化为NO
氧化为NO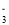 ,同时生成Cl-,该反应的离子方程式为________。
,同时生成Cl-,该反应的离子方程式为________。