-
化学与生产、生活密切相关,下列说法正确的是
A.煤经过气化和液化等物理变化可转化为清洁燃料
B.可用84消毒液(主要成分为NaClO)消杀新冠病毒
C.植物油与水互不相溶,可以用于萃取溴水中的溴
D.纤维素在人体内可水解为葡萄糖,可作人类的营养物质
难度: 简单查看答案及解析
-
下列做法不符合绿色化学理念的是
A.煤燃烧时加入生石灰固硫 B.工业利用氢气在氯气中燃烧制盐酸
C.以铜和浓硝酸为原料生产硝酸铜 D.在汽油中添加部分乙醇作汽车燃料
难度: 简单查看答案及解析
-
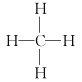
下列有关化学用语表示正确的是
A.甲烷的分子式:
 B.Mg2+的结构示意图:
B.Mg2+的结构示意图: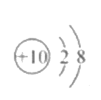
C.NH4C1电子式:
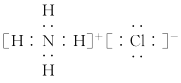 D.中子数为7的碳原子:
D.中子数为7的碳原子:
难度: 简单查看答案及解析
-
工业合成NH3反应的化学方程式为N2+3H2
 2NH3,下列关于该反应的说法正确的是
2NH3,下列关于该反应的说法正确的是A.升高温度可以减慢反应速率
B.减小N2的浓度可以加快反应速率
C.使用恰当的催化剂能加快反应速率
D.达到化学平衡时,N2转化率为100%
难度: 简单查看答案及解析
-
某反应A→C反应进程曲线如图所示,下列叙述正确的是
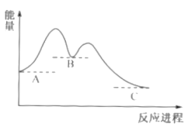
A.B的能量最低
B.反应过程中两个阶段均放出热量
C.反应A→C的条件一定为加热
D.反应A→C属于放热反应
难度: 简单查看答案及解析
-
下列关于化学键的说法中正确的是
A.化学键的形成过程中一定伴随着电子的得失
B.只要有化学键的断裂,一定发生化学反应
C.在共价化合物分子内,一定不存在离子键
D.某物质熔融状态时能导电,则该物质中一定含有离子键
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.1.8gD2O中含有的质子数、电子数均为NA
B.136g熔融的KHSO4中含有2NA个阳离子
C.3.0g乙烷中含极性键数目为0.6NA
D.标准状况下,2.24LCH2Cl2含有的原子数为0.5NA
难度: 简单查看答案及解析
-
下列关于电池的说法正确的是
A.太阳能电池的主要材料是高纯度的二氧化硅
B.电池工作时,电子从负极经外电路流向正极,再经过电解质流回负极
C.铅蓄电池(电解质溶液是硫酸)放电时的正极反应为PbO2+2e-+4H+=Pb2++2H2O
D.氢氧燃料电池,通入氢气的电极为电池的负极
难度: 简单查看答案及解析
-
下列实验能获得成功的是
A.用水鉴别苯、溴苯、乙醇
B.室温下,苯与稀硝酸混合制备硝基苯
C.用KMnO4/H+除去乙醇中混有的乙酸
D.用H2除去乙烯中的乙烷
难度: 中等查看答案及解析
-
在一个恒容密闭容器中发生如下反应:2SO2(g)+O2(g)
 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为1.0mo1•L-1、1.0mo1•L-1、0.5mo1•L-1,当反应达到最大限度时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为1.0mo1•L-1、1.0mo1•L-1、0.5mo1•L-1,当反应达到最大限度时,可能出现的数据是A.c(SO3)=1.5mo1•L-1 B.c(O2)=c(SO3)=0.75mo1•L-1
C.c(O2)=1.25mo1•L-1 D.c(SO2)+c(SO3)=1.5mo1•L-1
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是
A.正丁烷与异丁烷互为同系物
B.由乙烯与H2O反应生成乙醇属于取代反应
C.甲烷与足量氯气反应生成四种有机物
D.油脂和蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
某有机物的结构简式如图所示。则下列说法正确的是

A.该物质苯环上一氯代物有5种
B.1mo1该物质能与2mo1NaOH反应
C.在一定条件下,该物质分子间可发生取代反应
D.该物质所有碳原子不可能共面
难度: 中等查看答案及解析
-
下列常见金属冶炼原理正确的是
A.加热分解法制备铝 B.电解法制备钠
C.热还原法制备钙 D.加热分解法制备铁
难度: 简单查看答案及解析
-
锰-锂锂离子电池结构如图所示。放电时总反应为:C(Li)+LiMn2O4=C+Li2Mn2O4[C(Li)表示锂原子嵌入石墨形成的复合材料]。下列说法错误的是
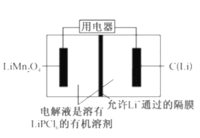
A.放电时,C(Li)为电池的负极
B.电解质溶液用稀H2SO4效果更好
C.放电时,电极LiMn2O4发生还原反应
D.负极反应为C(Li)-e-=C+Li+
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z在周期表中的位置关系如下表所示,其中W与Z可形成分子WZ4,该分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是
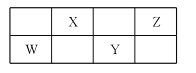
A.简单阴离子还原性:Z>Y
B.简单气态氢化物热稳定性:X>W
C.W、X、Y的氧化物均为酸性氧化物
D.元素W、Y在自然界中均只能以化合态存在
难度: 中等查看答案及解析
-
根据下列实验操作对应的现象和结论均正确的是
选项
实验操作
现象
结论
A
向NaC1粉末中加入适量酒精,充分振荡形成无色透明液体,用激光笔照射
出现一条光亮通路
形成的分散系是胶体
B
向2支分别盛有5mL0.1mo1∙L-1、1.0mo1.L-1NaHSO3溶液的试管中同时加入2mL5%H2O2溶液
均有气泡产生且1.0mo1∙L-1NaHSO3溶液产生气泡快
浓度大的NaHSO3溶液反应速率快
C
取4mL淀粉溶液,加入5mL稀硫酸,加热5min后,再加入少量新制的Cu(OH)2,加热至沸腾
没有出现砖红色沉淀
淀粉未水解
D
将Mg片和A1片用导线相连后,同时插入NaOH溶液中
Mg片上产生气泡
A1的金属性比Mg强
A.A B.B C.C D.D
难度: 中等查看答案及解析
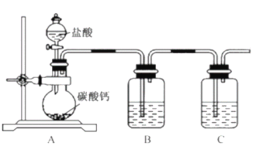
 E反应的实验装置如右图,该反应的化学方程式为______________;装置中溶液M为______________(填“饱和Na2CO3溶液”或“浓NaOH溶液”)反应结束后,将试管中收集到的产品倒入______________(填仪器名称)中,静置、分层,然后分离出E。
E反应的实验装置如右图,该反应的化学方程式为______________;装置中溶液M为______________(填“饱和Na2CO3溶液”或“浓NaOH溶液”)反应结束后,将试管中收集到的产品倒入______________(填仪器名称)中,静置、分层,然后分离出E。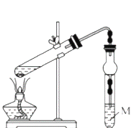
 N2(g)+CO2(g),NO物质的量变化如下表所示。
N2(g)+CO2(g),NO物质的量变化如下表所示。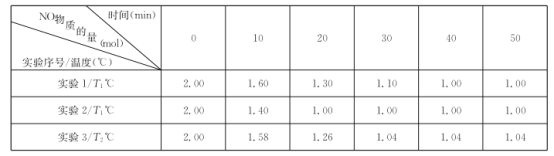
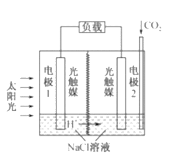
 2HCOOH+O2,装置如图所示。
2HCOOH+O2,装置如图所示。