-
分子式为C5H10O2的酯共有(不考虑立体异构) :
A.7种 B.8种 C.9种 D.10种
难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
A.①②③④ B.①②③ C.①②④ D.②③④
难度: 中等查看答案及解析
-
化学与日常生活密切相关,下列说法错误的是
A.碘酒是指单质碘的乙醇溶液
B.84消毒液的有效成分是NaClO
C.浓硫酸可刻蚀石英制艺术品
D.装饰材料释放的甲醛会造成污染
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层8电子稳定结构的是( )
A.BeCl2 B.CH4 C.BF3 D.PCl3
难度: 简单查看答案及解析
-
下列各组物质含有的化学键类型完全相同的是:
A.NaOH、CaCl2、CaO B.Na2O、Na2O2、Na2S
C.NaCl、HCl、H2O D.HBr、CO2、NH3
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )
元素代号
X
Y
Z
W
Q
原子半径/pm
130
118
75
73
102
主要化合价
+2
+3
+5、-3
-2
+ 6、- 2
A.X、Y元素的金属性:X<Y B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.W、Q两种元素的气态氢化物的热稳定性:H2W>H2Q D.X的最高价氧化物对应的水化物的碱性弱于Y的
难度: 中等查看答案及解析
-
茶是我国的传统饮品,茶叶中含有茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
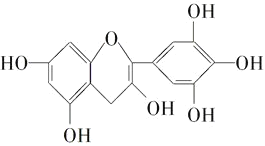
①分子式为C15H12O7;②1mol儿茶素A在一定条件下最多能与7mol H2加成;③等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应消耗金属钠和氢氧化钠的物质的量之比为1:1;④1mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4mol。
A.①④ B.②③ C.③④ D.①②
难度: 中等查看答案及解析
-
现有乙二醇(C2H6O2)与醋酸(CH3COOH)组成的混合物,测得其中氢元素的质量分数为9%,则混合物中氧元素的质量分数为( )
A.52% B.37% C.16% D.无法确定
难度: 中等查看答案及解析
-
关于化合物2−苯基丙烯(
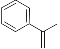 ),下列说法正确的是
),下列说法正确的是A.不能使稀高锰酸钾溶液褪色
B.可以发生加成聚合反应
C.分子中所有原子共平面
D.易溶于水及甲苯
难度: 中等查看答案及解析
-
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是( )
A.
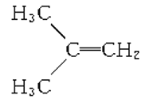 B.
B.
C.
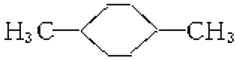 D.
D.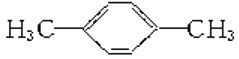
难度: 简单查看答案及解析
-
下列有机物命名正确的是( )
A.
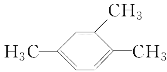 1,2,3—三甲苯
1,2,3—三甲苯B.
 2—氯丙烷
2—氯丙烷C.
 2—甲基—丙醇
2—甲基—丙醇D.
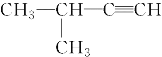 2—甲基—3—丁炔
2—甲基—3—丁炔难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作
实验目的或结论
A
将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
检验水解产物中的氯离子
B
乙醇与浓硫酸加热到170℃,将所得气体通入溴水中
确定是否有乙烯生成
C
向工业酒精中加入无水硫酸铜
确定工业酒精中是否含有水
D
向淀粉水解后的溶液中直接加入新制的银氨溶液
检验是否有葡萄糖生成
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合表中信息判断下列说法不正确的是( )
共价键
H-H
F-F
H-F
H-Cl
H-I
E(kJ/mol)
436
157
568
432
298
A.432kJ/mol>E(H-Br)>298kJ/mol
B.表中最稳定的共价键是H-F键
C. H2(g)→2H(g)∆H=+436kJ/mol
D. H2(g)+F2(g)=2HF(g) ∆H=-25kJ/mol
难度: 简单查看答案及解析
-
某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是 ( )
A.2,2-二甲基-3-丁烯 B.2,2-二甲基-2-丁烯
C.2,2-二甲基-1-丁烯 D.3,3-二甲基-1-丁烯
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A. 7.8g苯所含碳碳双键数目为0.3NA
B. 28g乙烯所含共用电子对数目为6NA
C. 标准状况下,11.2 L溴乙烷所含分子数为0.5NA
D. 26g乙炔和苯乙烯的混合物,含有原子总数为6NA
难度: 中等查看答案及解析
-
为了提纯下列物质(括号内为杂质R所选用的除杂试剂与除杂方法都正确的是
不纯物
除杂试剂
除杂方法
A.
乙烷(乙烯)
H2
Ni/加热
B.
乙醇(水)
CuSO4
蒸馏
C.
乙酸乙酯(乙酸)
饱和Na2CO3溶液
分液
D.
乙酸(水)
Na
蒸馏
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3∶4。下列说法中正确的是
A.原子半径:W>Z>Y>X B.氢化物稳定性:Y>Z
C.WY3中只有离子键没有共价键 D.X与Z可形成10电子和18电子分子
难度: 中等查看答案及解析
-
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,结构如图,下列说法正确的是( )
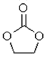
A.分子式为C3H6O3
B.分子中既有极性键也有非极性键
C.分子中σ键与π键个数之比为3:1
D.分子中碳原子的杂化方式全部为sp2杂化
难度: 中等查看答案及解析
-
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2−+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如图所示,下列说法不正确的是( )
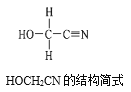
A.HOCH2CN分子中没有手性碳原子
B.1mol HOCH2CN分子中含有σ键的物质的量为5mol
C.[Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D.HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
难度: 中等查看答案及解析
-
向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.配位化合物中只有配位键
D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道
难度: 中等查看答案及解析
-
《梦溪笔谈》有记:馆阁新书净本有误书处,以雌黄涂之。在中国古代,雌黄(As2S3)经常用来修改错字,其结构如图所示。下列说法不正确的是( )
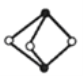
A.As、S原子的杂化方式均为sp3
B.AsH3的沸点比NH3的低
C.与As同周期且基态原子核外未成对电子数目相同的元素只有V
D.已知As2F2分子中各原子均满足8电子结构,分子中σ键和π键的个数比为3:1
难度: 中等查看答案及解析
-
下列说法正确的是
A.沸点高低:CH4>SiH4>GeH4 B.键角大小:BeCl2>BF3>NH3>H2O
C.熔点高低:金刚砂>石英>食盐 D.键能大小:O-H>P-H>S-H
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
酸性HCl>H2S
非金属性Cl>S
B
NH4Cl仅由非金属元素组成
NH4Cl是共价化合物
C
Na在Cl2中燃烧的生成物含离子键
NaCl固体可导电
D
向NaI溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈紫红色
I- 还原性强于Cl-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
木糖醇是一种新型的甜味剂,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的需要。它是一种白色粉末状的结晶,结构简式为如图。下列有关木糖醇的叙述中不正确的是
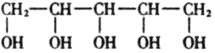
A.木糖醇是—种单糖,不能发生水解反应
B.已知木糖醇的溶解度随着温度的升高而增大,说明木糖醇的溶解过程是吸热过程
C.木糖醇易溶解于水,能发生酯化反应
D.1mol木糖醇与足量钠反应最多可产生2.5molH2
难度: 简单查看答案及解析
-
下列说法错误的是
A.蔗糖和麦芽糖均为双糖
B.酶是一类具有高选择催化性能的蛋白质
C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色
D.淀粉和纤维素水解的最终产物均为葡萄糖
难度: 简单查看答案及解析
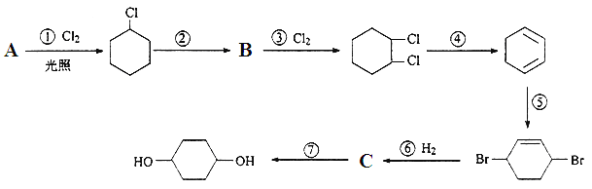
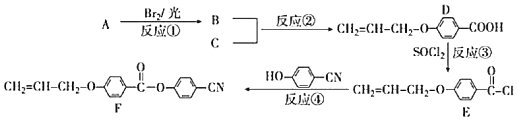
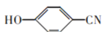 和乙烯为原料制备
和乙烯为原料制备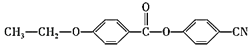 的合成路线流程图___(无机试剂任用)
的合成路线流程图___(无机试剂任用)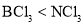 B. 物质的硬度:
B. 物质的硬度: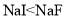
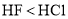 D.在
D.在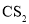 中的溶解度:
中的溶解度: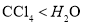

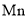 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态 可与
可与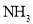 反应生成
反应生成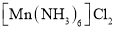 ,新生成的化学键为_____键。
,新生成的化学键为_____键。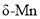 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, 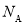 ,
, 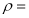 ____
____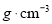 。(列出计算式)
。(列出计算式) +
+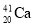 ===
===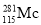 +3
+3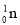 得到。该元素的质子数为________________,287Mc与288Mc互为_________________。
得到。该元素的质子数为________________,287Mc与288Mc互为_________________。