-
下列晶体中,不属于原子晶体的是
A、金刚石 B、水晶 C、晶体硅 D、冰
难度: 中等查看答案及解析
-
下列晶体熔化时不需破坏化学键的是
A、晶体硅 B、晶体硫 C、食盐 D、金属钾
难度: 中等查看答案及解析
-
某元素质量数52,中子数28,其基态原子未成对电子数为
A.3 B.4 C.5 D.6
难度: 中等查看答案及解析
-
下列化合物分子中的所有原子都处于同一直线的是
A.C2H2 B.C2H4 C.PCl3 D.BF3
难度: 中等查看答案及解析
-
下列有关物质结构的表述正确的是
A. 次氯酸的电子式
B. 二氧化硅的分子式SiO2
C. 硫原子的最外层电子排布式为3s23p4 D.钠离子的结构示意图为
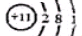
难度: 中等查看答案及解析
-
下列判断错误的是
A.沸点:NH3>PH3>AsH3 B. 碱性:NaOH>Mg(OH)2>Al(OH)3
C.酸性:HClO4>H2SO4>H3PO4 D. 熔点:SiC>NaCl>SiCl4
难度: 中等查看答案及解析
-
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下列判断正确的是
甲
乙
丙
丁
戊
A.原子半径:丙<丁<戊 B. 第一电离能:甲>丙
C.电负性:丙>丁>戊 D. 最外层电子数:甲>乙
难度: 中等查看答案及解析
-
下列判断正确的是
A.含有共价键的化合物一定是共价化合物
B.晶体中一定存在化学键
C.含有离子键的化合物一定是离子化合物
D.金属键越强,金属越活泼,金属熔点越高
难度: 中等查看答案及解析
-
下列仪器选择正确的是
A.用碱式滴定管量取17.12 mL KMnO4溶液
B.用50mL量筒量取7.5mL浓盐酸
C.蒸发结晶操作中须使用到坩埚、玻璃棒、酒精灯等
D.过滤操作时须使用到玻璃棒、烧杯和漏斗等玻璃仪器
难度: 中等查看答案及解析
-
下列实验操作或实验事故处理正确的是
A.使用托盘天平称量时,应将砝码放左边托盘
B.实验室制硝基苯时,采用热水浴加热
C.实验时手指上不小心沾上浓硫酸,立即用NaOH 溶液清洗
D.酒精不慎洒在实验桌上烧起来时,立即用水浇灭
难度: 中等查看答案及解析
-
某同学在设计实验中使用了以下数据: ① 用托盘天平称取无水Na2CO3 5.2g ② 用量筒取浓盐酸6.34毫升 ③用广泛PH试纸测得的PH值为7.8 ④用盐酸滴定Na2CO3溶液用去盐酸11.20毫升,其中数据不合理的是:
A. ①③ B. ①④ C. ②③ D. ②④
难度: 中等查看答案及解析
-
在实验室中,下列处理方法将会污染空气的是:
A.将Fe(NO3)2溶液和稀盐酸同时倒入废液缸中的试剂瓶
B. 用热纯碱溶液清洗盛过植物油的试管
C. 用酒精洗涤做碘升华实验后的烧杯
D. 用稀盐酸清洗长期存放过FeCl3溶液的试剂瓶
难度: 中等查看答案及解析
-
下列与实验相关的叙述正确的是
A. 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B. 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C. 酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D. 使用pH试纸测某溶液的pH时,应先将试纸润湿再测定
难度: 中等查看答案及解析
-
A、B均为短周期金属元素。依据下表数据判断一定错误的是
电离能
A
932
1821
15390
21771
B
738
1451
7733
10540
A.A元素的常见价态是是+2价 B.A的最高价氧化物的水化物可能是两性氢氧化物
C.电负性:A>B D.B原子的电子排布式为1s2 2s2
难度: 中等查看答案及解析
-
根据下表中四种物质的相关数据,下列分析错误的是
CH4
SiH4
NH3
PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1073
713.2
A. NH3的沸点比PH3高的原因是NH3分子间易形成氢键
B.CH4的分解温度比SiH4高的原因是C-H 的键长比Si-H短
C.NH3的分解温度比PH3高的原因是N-H 的键能比P-H的键能小
D.由于SiH4的相对分子质量比CH4大,范德华力更强,所以SiH4沸点比CH4高
难度: 中等查看答案及解析
-
下列说法正确的是
A. 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
B. 原子最外层电子数为1的元素一定处于周期表IA族
C. 氯化氢的沸点比氟化氢的沸点高
D. 同主族元素形成的氧化物的晶体类型均相同
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号[
X
Y
Z
W
原子半径/nm
0.130
0.118
0.102
0.073
主要化合价
+2
+3
+6、 -2
-2
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.Z的氢化物的沸点比W的氢化物高
难度: 中等查看答案及解析
-
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2—与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述错误的是
A. 1mol N2和1mol CO所含电子数均为14NA
B.17g H2O2中含有的σ键数为1.5NA
C.1mol Na2O2固体中含离子总数为4 NA
D.1mol晶体硅中含有Si-Si键数为2 NA
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,错误的是
A. X、M两种元素可以能形成两种离子化合物
B. 由于Y、Z、W元素的氢化物共价键的键能依次增大,氢化物的热稳定性依次增强
C. 化合物YM2和ZM2的晶体类型相同
D. H2M的沸点高于H2Z是因为形成分子间氢键的缘故
难度: 中等查看答案及解析