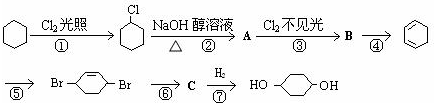
-
用相对分子质量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( )
A.3种
B.4种
C.5种
D.6种难度: 中等查看答案及解析
-
有机物A和B,只由C、H、O两种或三种元素组成,相同物质的量的A和B完全燃烧时,消耗氧气的物质的量相等,下列对A、B的判断错误的是( )
A.A与B可能互为同分异构体
B.A与B的分子组成可能只相差n个“CH2”
C.A与B的分子组成可能只相差n个“CO2”
D.A与B的分子组成可能只相差n个“H2O”难度: 中等查看答案及解析
-
2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.把世博会期间产生的垃圾焚烧或深埋处理
C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体难度: 中等查看答案及解析
-
已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中正确的是( )

A.由红外光谱可知,该有机物中只含有二种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C.仅由其核磁共振氢谱可知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3难度: 中等查看答案及解析
-
有机物
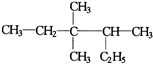 的正确命名为( )
的正确命名为( )
A.2-乙基-3,3-二甲基-4-乙基戊烷
B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷
D.2,3,3-三甲基己烷难度: 中等查看答案及解析
-
某有机物结构简式为
,下列说法错误的是( )
A.能被酸性高锰酸钾溶液氧化
B.能与溴水发生加成反应褪色
C.能发生加聚反应
D.该分子中至少有16个原子在苯环所在平面难度: 中等查看答案及解析
-
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度发生改变难度: 中等查看答案及解析
-
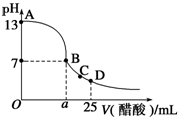
强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.醋酸、浓硫酸、稀硝酸分别与0.1mol•L-1NaOH溶液恰好完全反应放出的热量与消耗NaOH溶液的体积的关系如图所示.则下列描述正确的是( )

A.A表示稀硝酸与NaOH溶液的反应
B.B表示醋酸与NaOH溶液反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液反应难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C.沉淀转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动
D.pH为10的氨水,由水电离出的氢氧根离子浓度为10-4 mol/L难度: 中等查看答案及解析
-
下列有关实验的叙述中,合理的是( )
①用广泛pH试纸测得氯水的pH为2.5
②中和滴定时,滴定管洗净后经蒸馏水润洗,再注入标准液进行滴定
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥用已知浓度的NaOH溶液滴定未知浓度的HCl溶液,滴定开始时读数平视,结束时俯视,测得结果偏小.
A.②④⑤
B.②③⑥
C.①②③
D.④⑥难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法中正确的是( )
A.1mol甲基所含电子数为9NA
B.合成氨反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g);△H=-92.4 KJ/mol,则一定条件下在密闭容器中,放入NA个N2分子和3NA 个H2分子充分反应放出热量为92.4KJ
C.标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8NA
D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA难度: 中等查看答案及解析
-
能够鉴定氯乙烷中氯元素的存在的最佳操作是( )
A.在氯乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液难度: 中等查看答案及解析
-
苯分子的结构中,不存在C-C键和C=C键的简单交替结构,下列事实中可以作为依据的有( )
①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长均相等;
③苯在加热和催化剂存在条件下氢化生成环己烷;
④经实验测得邻二甲苯只有一种结构;
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色.
A.①②④⑤
B.①②③④
C.①③④⑤
D.②③④⑤难度: 中等查看答案及解析
-
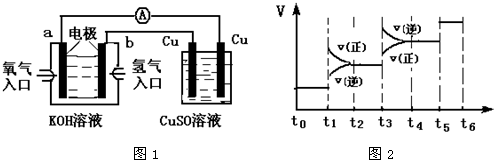
对于可逆反应,mA(g)+nB(g)⇌pC(g)+qD(g);H<0有下列判断,其中正确的是( )

A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,都能实现如图中a→b的变化难度: 中等查看答案及解析
-
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1mol二甲醚被还原时有12mol电子转移难度: 中等查看答案及解析
-
如图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极.接通电源后,发现d点显红色.下列有关说法正确的是( )
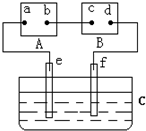
A.电源A上的a极是正极
B.d极上的电极反应方程式为2Cl--2e-=Cl2↑
C.e、f极上产生的气体体积比为2:1
D.电解槽C中溶液的pH增大难度: 中等查看答案及解析
-
两只串联的电解池,左池放CuSO4溶液,右池放一定量的某硝酸盐稀溶液,电解时,当左池析出1.6g铜时,右池析出0.45g固体,则右池中的溶质为( )
A.AgNO3
B.NaNO3
C.Mg(NO3)2
D.Al(NO3)3难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是( )
A.0.1mol/L HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1L mol/L Cu(NH4)2(SO4)2•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol/L NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)难度: 中等查看答案及解析