-
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu=Cu2++2e-
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥难度: 中等查看答案及解析
-
下列反应的离子方程式中,正确的是( )
A.碳酸钙与醋酸反应:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.向氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
C.次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.硫酸与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O难度: 中等查看答案及解析
-
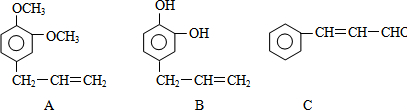
下列涉及有机物的说法正确的是( )
A.苯能与溴单质发生取代反应,因此不能用苯萃取溴水中的溴
B.丙烷是一种清洁燃料,可用作燃料电池的燃料
C.淀粉和纤维素水解产物都是葡萄糖,因此二者互为同分异构体
D.苯乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.Ca2+、HCO3-、Cl-、K+
B.Al3+、AlO2-、OH-、Na+
C.Fe3+、NH4+、SO42-、I-
D.Fe3+、SCN-、Na+、CO32-难度: 中等查看答案及解析
-
下列关于NA说法正确的是( )
A.0.1 mol 过氧化钠与足量水反应生成的O2分子数为0.1 NA
B.100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子数均为0.2NA
C.室温下,28.0g乙烯和丙烯混合气体中含有的碳原子数为2NA
D.标准状况下,11.2L臭氧中含有的氧原子数目为3NA难度: 中等查看答案及解析
-
X、Y、Z、Q均为短周期元素,它们在周期表中位置如图所示.若X原子的最外层电子数是内层电子数的2倍.下列说法中,正确的是( )
A.X与Q的化合物中含有共价键
B.最高价氧化物对应水化物的酸性:Q比Z弱
C.14X和14Y具有相同的质量数,互为同位素
D.Q与Fe反应生成的化合物中,铁元素显+3价难度: 中等查看答案及解析
-
下列因果关系正确的是( )
A.因为钾的金属性比钠强,所以钾可以在NaCl溶液中置换出钠
B.因为Cl2与氢氧化钠溶液反应生成盐和水,所以Cl2是酸
C.因为过氧化钙与过氧化钠的性质相似,所以过氧化钙也可以跟水反应能放出氧气
D.因为常温下铁和铝遇浓硫酸都能形成致密氧化膜,所以通常情况下铁和铝都不需要采取特别的防腐措施难度: 中等查看答案及解析
-
下列实验操作中正确的是( )
A.可用丁达尔现象区别溴水和Fe(OH)3胶体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.H2还原CuO实验中,当固体变红,停止加热后,再通一会儿H2
D.测溶液的pH值需先用蒸馏水润湿PH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,与标准比色卡对照难度: 中等查看答案及解析