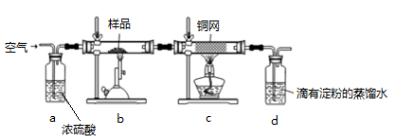
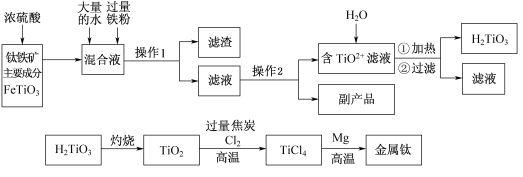
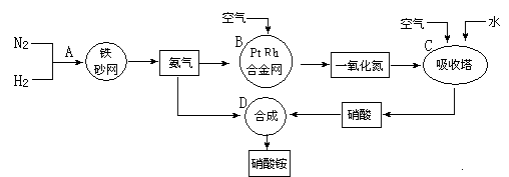
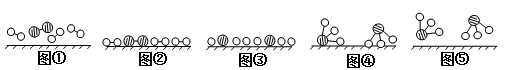
-
下列对有机反应类型的描述不正确的是
A.乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应
B.将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应
C.乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应
D.甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应
难度: 简单查看答案及解析
-
化学与生产、生活和社会密切相关。下列说法正确的是
A.用米汤检验碘盐中的碘
B.用热的烧碱溶液洗涤餐具上的油污
C.“地沟油”禁止食用,但可用来制取肥皂
D.将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用
难度: 简单查看答案及解析
-
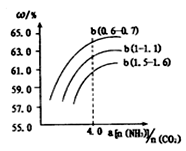
X 、Y 、Z 、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和。下列叙述一定正确的是
A.含氧酸酸性R>X B.简单氢化物稳定性Y<X
C.最高正化合价Z< X <Y< R D.由Z和R形成的化合物为离子化合物
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法中,正确的是
A.常温常压下,l.6g
中含有共价键总数为0.4NA
B.密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA
C.1L0.lmol·L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA
难度: 中等查看答案及解析
-
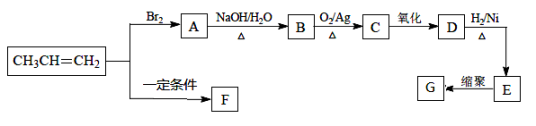
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,
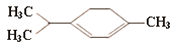
该有机物的一氯取代物有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
难度: 简单查看答案及解析
-
下列实验“操作”“现象”与“结论”都正确的是
操作
现象
结 论
A
向白色AgCl悬浊液中滴加0.1mol/LKI溶液
试管中白色沉淀转化为黄色沉淀。
Ksp(AgCl)>Ksp(AgI)
B
向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4
溶液颜色基本不变
Fe(NO3)2与H2SO4不反应
C
向Na2SiO3溶液中滴加盐酸
溶液变浑浊
非金属性:Cl>Si
D
SO2通入足量的稀Fe(NO3)3溶液
溶液由棕黄色变为浅绿色,后立即又变成棕黄色
氧化性:HNO3>H2SO4>Fe3+
难度: 简单查看答案及解析
-
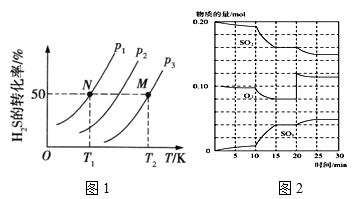
下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图。下列说法正确的是
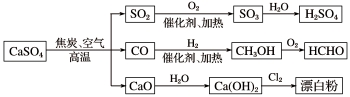
A.CO、SO2、SO3均是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH,原子利用率为100%
难度: 简单查看答案及解析