-
中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
A. 用胆矾炼铜 B. 用铁矿石炼铁 C. 烧结粘土制陶瓷 D. 打磨磁石制指南针
难度: 简单查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑。对上述反应的描述错误的是( )
A. NaN3是还原剂,KNO3是氧化剂
B. 该反应中有两种元素的化合价发生变化
C. 配平后物质的系数依次为 10、2、1、5、16
D. 若生成 8 mol N2,则转移电子的物质的量为 5 mol
难度: 中等查看答案及解析
-
胶体的本质是 ( )
A. 具有丁达尔效应 B. 可以透过滤纸
C. 可做布朗运动 D. 分散质粒子的直径在1---100nm之间
难度: 简单查看答案及解析
-
下列离子方程式正确的是 ( )
A. 漂白粉溶液中通入少量二氧化碳气体:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B. 钠与硫酸铜溶液反应: Cu2+ + 2Na = 2Na+ + Cu
C. 铁屑溶于过量稀硝酸:3Fe + 8H+ + 2NO3-=3Fe2+ + 2NO↑+ 4H2O
D. FeI2溶液中通入少量氯气:2Fe2+ + Cl2= 2Fe3+ + 2Cl-
难度: 中等查看答案及解析
-
在一定条件下,O2F2可以发生反应:H2S+3O2F2=SF4+2HF+3O2。则O2F2中O的化合价为 ( )
A. -2 B. -1 C. +1 D. +2
难度: 中等查看答案及解析
-
随着人们生活节奏的加快,方便的袋装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,常在袋装食品内放入一小袋固体,在该小袋中应 放入的化学物质是 ( )
A. 无水硫酸铜、蔗糖 B. 生石灰、硫酸亚铁 C. 食盐、硫酸亚铁 D. 生石灰、食盐
难度: 中等查看答案及解析
-
下列说法不正确的是 ( )
A. 标准状况下,等体积的CH4和CO2分子数相等
B. 与NaOH溶液、稀硫酸反应产生等量的H2,所需铝粉的质量相等
C. 常温下,铜与浓硫酸迅速反应产生SO2气体
D. 1mol OH- 和17g NH3所含的电子数相等
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 1 L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C. 配制500mL0.1 mol·L-1的CuSO4溶液,需8.0g 无水CuSO4
D. 中和100mL1mol/L的H2SO4溶液,需NaOH为4.0 g
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
B. 标准状况下,22.4L 己烷中共价键数目为19NA
C. 常温常压下的33.6L 氯气与27g铝充分反应,转移电子数为3NA
D. 1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
难度: 中等查看答案及解析
-
仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的的是( )
A. 除去CO2气体中混有的的少量HCl:导管、洗气瓶
B. 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿
C. 用CCl4提取碘水中的碘:分液漏斗、烧杯
D. 用18.4 mol·L-1浓硫酸配制100mL 1.0 mol·L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管
难度: 中等查看答案及解析
-
取一小块金属钠放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属钠熔化 ②在空气中燃烧,火焰为紫色 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A. ①② B. ①②③ C. ①④⑤ D. ④⑤
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是( )
A. 在酸性溶液中:Na+、K+、Cl-、NO3-
B. 在强碱性溶液中:NH4+、K+、SO42-、CO32-
C. 在含有大量AlO2-的溶液中:NH4+、Cu2+、Cl-、H+
D. 在c(H+)=0.1mol·L-1的溶液中:K+、Na+、HCO3-、NO3-
难度: 中等查看答案及解析
-
同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是( )
A. b>a>c B. a=b=c
C. c>a>b D. b>c>a
难度: 中等查看答案及解析
-
下列物质中不属于合金的是( )
A. 水银 B. 黄铜 C. 碳素钢 D. 青铜
难度: 简单查看答案及解析
-
下列微粒不具有还原性的是 ( )
A. H2 B. H+ C. Na D. CO
难度: 简单查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A. FeO B. Fe2O3 C. FeSO4 D. Fe3O4
难度: 中等查看答案及解析
-
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
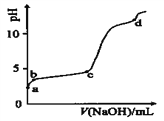
A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-
Al(OH)3
B. a→b段,溶液pH增大,Al3+浓度不变
C. b→c段,加入的OH-主要用于生成Al(OH)3沉淀
D. d点时,Al(OH)3沉淀开始溶解
难度: 中等查看答案及解析
-
下列操作或装置能达到实验目的的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式为C6H12O2的有机物,该物质能发生银镜反应,且在酸性条件下水解为A和B。不考虑立体异构,满足条件的该有机物的同分异构体共有( )
A. 8种 B. 7种 C. 10种 D. 12种
难度: 中等查看答案及解析
-
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
难度: 简单查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H < 0。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
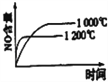 B.
B. 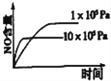
C.
 D.
D. 
难度: 困难查看答案及解析
-
如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是 ( )
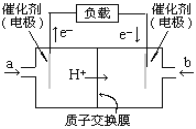
A. 左边的电极为电池的负极,a处通入的是甲醇
B. 右边的电极为电池的负极,b处通入的是空气
C. 电池负极的反应式为:CH3OH+H2O+6e-=CO2+6H+
D. 电池的正极反应式为:O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是( )
A. 向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3
B. 向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性
C. 将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊
D. 向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3
难度: 中等查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
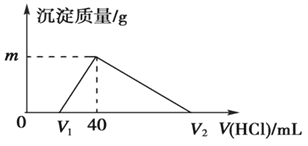
A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
难度: 中等查看答案及解析