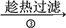-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A. 范德华力、范德华力、范德华力 B. 范德华力、范德华力、共价键
C. 范德华力、共价键、共价键 D. 共价键、共价键、共价键
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高价氧化物对应水化物的酸性比W的弱
D. Y的气态简单氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
设阿伏加德罗常数(NA)的数值为nA,下列说法不正确的是( )
A. 1 mol Cl2与足量Fe反应,转移的电子数为2nA
B. 1.5 mol NO2与足量H2O反应,转移的电子数为nA
C. 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D. 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性离子:Na+、NH4+、SO42-、NO3-、Mg2+、Al3+、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
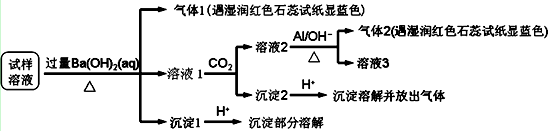
已知:3NO3-+8Al+5OH-+2H2O3NH3↑+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
C. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol/L的目标分子
D. 向汽油中添加甲醇后,该混合燃料的热值不变
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A. 甲的分子数比乙的分子数多 B. 甲的物质的量比乙的物质的量少
C. 甲的摩尔体积比乙的摩尔体积小 D. 甲的相对分子质量比乙的相对分子质量小
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 1 mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B. 1 mol臭氧中和1.5mol氧气含有相同的氧原子数
C. 等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
D. 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3
难度: 中等查看答案及解析
-
下列操作不能达到目的的是( )
选项
目的
操作
A.
配制100 mL 1.0 mol/L CuSO4溶液
将25 g CuSO4·5H20溶于100 mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将MnO4-完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
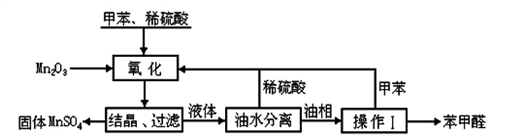
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:( )
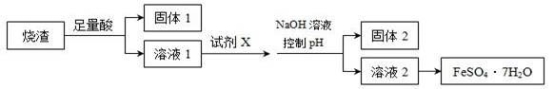
下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 困难查看答案及解析
-
金属钠能在无水液氨中溶解为蓝色的液态氨溶液,蓝色据认为是生成了电子的氨合物即e(NH3)n-的缘故,有反应:Na+nNH3
Na++e(NH3)n-,小心蒸去氨,可得到白色固体NaNH2而且应该有以下反应发生:2Na+2NH3
2NaNH2+H2,则下列有关说法中,不正确的是 ( )
A. 液氨不能够发生电离 B. 纳的氨溶液有强的还原剂
C. 液氨能发生电离,有NH4+和NH2-生成 D. 蒸发液氨的钠溶液时,蓝色会逐渐褪色
难度: 中等查看答案及解析
-
下列反应中的氨与反应4NH3+5O2→4NO+6H2O中的氨作用相同的是( )
A. 2Na+2NH3→2NaNH2+H2↑ B. 2NH3+3CuO→3Cu+N2+3H2O
C. 4NH3+6NO→5N2+6H2O D. 3SiH4+4NH3→Si3N4+12H2
难度: 困难查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中( )
A. 硫元素被氧化,碳元素被还原
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
难度: 困难查看答案及解析
-
一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定)。假设气体通过每个洗气瓶都能充分反应,则尾气(已干燥)( )
A. 可能是单一气体 B. 不可能含有一氧化碳
C. 可能存在原气体中的两种气体 D. 成分和洗气瓶的排列顺序无关
难度: 困难查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化物比还原物多1.75mol,则下列判断正确的是( )
A. 生成42.0LN2(标准状况)
B. 有0.250molKNO3被氧化
C. 转移电子的物质的量为1.25mol
D. 被氧化的N原子的物质的量为3.75mol
难度: 困难查看答案及解析
-
在一定条件下,N2O分解的部分实验数据如下:
反应时间/min
0
10
20
30
40
50
60
70
80
90
100
c(N2O)/mol·L–1
0.10
0.09
0.08
0.07
0.06
0.05
0.04
0.03
0.02
0.01
0.00
下图能正确表示该反应有关物理时变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度,且c1<c2)
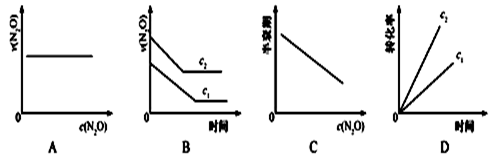
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
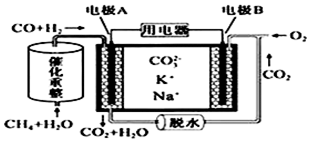
A. 反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol电子
B. 电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C. 电池工作时,CO32﹣向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
难度: 困难查看答案及解析