-
下列关于金属的说法中不正确的是( )
A. 合金比纯金属具有较好的性能,一般情况下,硬度比纯金属高,熔点比纯金属的低
B. 合金仍然具有金属特性
C. 常用电解法冶炼钠、镁、铝等活泼金属
D. 将钢闸门与电源正极相连,可防止其在海水中被腐蚀
难度: 中等查看答案及解析
-
下列有关金属的说法中正确的是( )
A. 钠在空气中燃烧只生成白色的氧化钠固体
B. 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C. 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D. 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
难度: 中等查看答案及解析
-
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为

A.
B.
C.
D.
难度: 中等查看答案及解析
-
把铝粉和Fe2O3粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后再与足量盐酸反应,另一份直接放入足量的浓烧碱溶液中充分反应。前后两种情况下生成的气体质量比为
A. 2∶1 B. 3∶2 C. 2∶3 D. 1∶1
难度: 简单查看答案及解析
-
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化

则转化过程中所加稀HNO3的物质的量浓度为
A. 4.4 mol·L-1 B. 3.6 mol·L-1 C. 4.0 mol·L-1 D. 3.2 mol·L-1
难度: 中等查看答案及解析
-
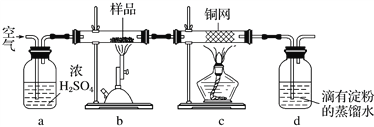
用下列装置不能达到有关实验目的的是
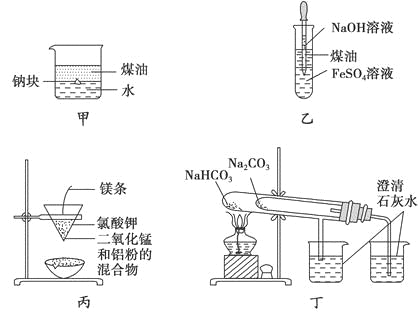
A. 用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
向2 mL 0.5 mol·L-1的FeCl3溶液中加入3 mL 3 mol·L-1 KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是
A. Fe3+不与I-发生反应
B. Fe3+与F-结合成不与I-反应的物质
C. F-使I-的还原性减弱
D. Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是 ( )
选项化合物
A
B
C
D
Y
CO2
Fe2O3
SiO2
FeCl3
W
MgO
Al2O3
CO
CuCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定条件下,五种含有同种金属元素的单质或其化合物,能按如图箭头方向实现一步转化(不含电解),该金属元素可能是( )
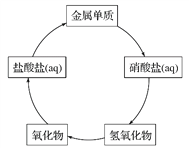
①Fe ②Cu ③Al ④Na
A. ①② B. ②④
C. ①③ D. ③④
难度: 困难查看答案及解析
-
关于FeCl3进行的实验,下列预测正确的是( )
选项
实验
预测
A
蒸发FeCl3溶液
得到FeCl3固体
B
在FeCl3、CuCl2混合液中,加入少量Fe粉
一定有H2产生且有Cu析出
C
用FeCl3固体溶于水配制饱和溶液
会有Fe(OH)3沉淀产生
D
在FeCl3溶液中加入KHCO3溶液
有CO2产生,但无Fe(OH)3沉淀生成
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是
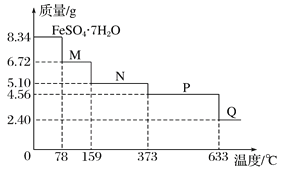
A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑
难度: 中等查看答案及解析
-
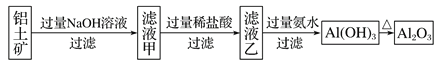
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
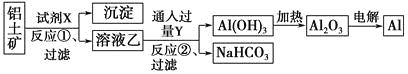
下列叙述正确的是 ( )。
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
难度: 中等查看答案及解析
-
下列事实及其解释不正确的是( )。
A. 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B. 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C. 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D. 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
难度: 困难查看答案及解析
-
下列常见实验的现象或表述正确的是( )
A. 向某溶液中加入2滴KSCN溶液,溶液不显血红色,再向溶液中加入几滴新制的氯水,溶液变为血红色,该溶液中一定含有Fe2+
B. 为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为血红色,说明红砖中只有三氧化二铁
C. 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D. 将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质
难度: 困难查看答案及解析
-
工业上真空炼铷的原理为2RbCl+Mg
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 铝、铁、铜相比较,铜元素在自然界中的含量最低、铁元素含量最高
B. A12O3、MgO可用作高温材料,二氧化硅是生产光纤制品的基本原料
C. 工业上采用电解熔融态A12O3、MgO的方法冶炼Al、Mg
D. 用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
难度: 简单查看答案及解析