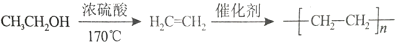-
“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸是一种天然高分子材料,下列不属于高分子材料的是
A. PVC塑料 B. 光导纤维 C. 氯丁橡胶 D. 有机玻璃
难度: 简单查看答案及解析
-
中华文化源远流长、博大精深。从化学的视角看,下列理解正确的是
A. “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化
B. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
C. “所在山洋,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作
D. “丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是升作和凝华过程
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,37g37Cl2中所含的中子数为20NA
B. 标准状况下,11.2L三氯甲烷所含C-C1键数目为1.5NA
C. 若将1mol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
D. 一定条件下,0.2 molSO2 与足量O2充分反应,生成SO3 分子数为0.2NA
难度: 中等查看答案及解析
-
有机物M、N、Q的转化关系如下图所示,下列说法正确的是

A. M 的名称是2一甲基一丁烷
B. N在NaOH 的水溶液中发生消去反应生成Q
C. Q分子中所有的碳原子一定共面
D. N 的同分异构体有7 种(不考虑立体异构,不包括本身)
难度: 中等查看答案及解析
-
PASS 是新一代高效净水剂,它由X、Y、Z、W、R 五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R 同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3 倍,Z 是常见的金属元素,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料。下列说法正确是
A. Y、Z、R简单离子的半径依次减小 B. X 和Y 形成的化合物中只含有极性共价键
C. 热稳定性: X2R< WX4 D. Z与Y 形成的化合物是一种耐高温材料
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
常温下将Al 片插入浓硫酸中
无明显现象
A1片和浓硫酸不反应
B
将溴水滴加到淀粉KI 溶液中
溶液变蓝
非金属性: Br>I
C
将某化合物在酒精灯上灼烧
焰色为黄色
该化合物是钠盐
D
向AgI 沉淀中滴入KCl溶液
有白色沉淀出现
Ksp(AgCl)<Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示,下列说法正确的是
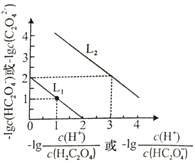
A. 曲线L1表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.lmol/LH2C2O4溶液中加入少量水[c(HC2O4-)/c(H2C2O4)]减小
难度: 困难查看答案及解析

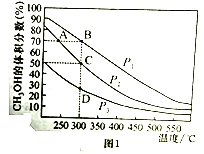
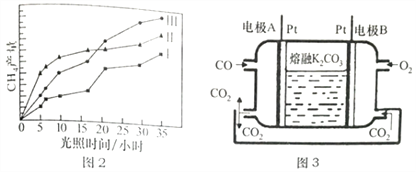
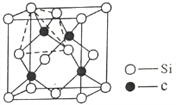

 (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子) (R1、R2 为烃基或氢原子)
(R1、R2 为烃基或氢原子)