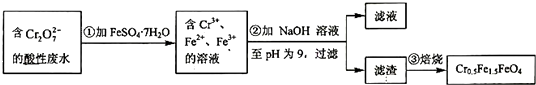
-
向体积为Va的0.05mol•L-1CH3COOH溶液中加入体积为Vb的0.05mol•L-1KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)难度: 中等查看答案及解析
-
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
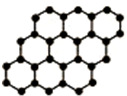
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合难度: 中等查看答案及解析
-
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )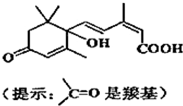
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基难度: 中等查看答案及解析
-
下列选用的相关仪器符合实验要求的是( )
A B C D 存放浓硝酸 分离水和乙酸乙酯 准确量取9.50mL水 实验室制取乙烯 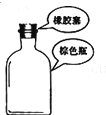
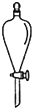

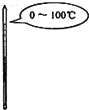
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是( )
A.NH4+、H +、NO3-、HCO3-
B.K+、Al3+、NH3•H2O
C.Na+、Fe2+、Cl2
D.Na+、CH3COO-、OH-难度: 中等查看答案及解析
-
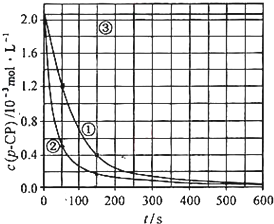
汽车尾气净化中的一个反应如下:NO(g)+CO(g)⇌
N2(g)+CO2(g)△H=-373.4kJ•mol-1.在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
A.
B.
C.
D.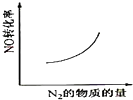
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O═Cu2O+H2↑.下列说法正确的是( )
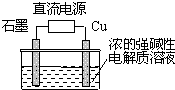
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成难度: 中等查看答案及解析
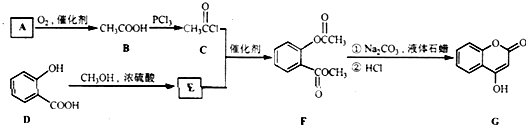
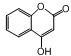 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: