-
化学家于1995年合成了一种分子式为C200H200的含有多个碳碳叁键的链烃,其分子中含有碳碳叁键数目最多可以是( )
A.49 B.50 C.51 D.无法确定
难度: 简单查看答案及解析
-
卤代烃能够发生下列反应: 2CH3CH2Br+2Na → CH3CH2CH2CH3+2NaBr。下列有机物可合成环丙烷的是 ( )
A.CH3CH2CH2Cl B.CH3CHBrCH2Br
C.CH2BrCH2CH2Br D.CH3CHBrCH2CH2Br
难度: 中等查看答案及解析
-
有7 种物质,①甲烷 ②苯 ③2-丁炔 ④环己烷 ⑤邻二甲苯 ⑥环己烯 ⑦二氧化硫,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
A. ③⑥⑦ B. ②④⑥⑦ C. ②⑤⑥⑦ D. ④⑤⑥
难度: 困难查看答案及解析
-
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
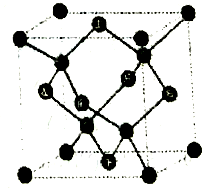
下列有关冰晶胞说法正确的是
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏。
难度: 困难查看答案及解析
-
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
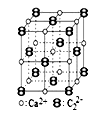
A.1 个 Ca2+周围距离最近且等距离的 C22-数目为 6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
难度: 中等查看答案及解析
-
共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是( )
A.SiO2晶体 B.Ar晶体 C.NaCl晶体 D.NaOH晶体
难度: 中等查看答案及解析
-
科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示。该化合物中的K原子和C60分子的个数比为
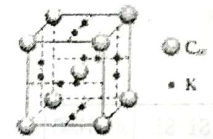
A. 1:3 B. 3:1 C. 3:2 D. 2:3
难度: 中等查看答案及解析
-
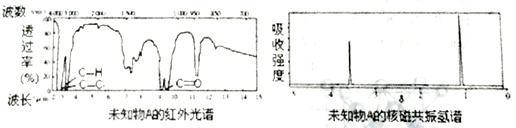
有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示,它的核磁共振氢谱图中吸收峰数日与峰面积之比分别为
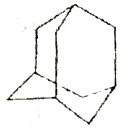
A. 5,1:6:2:3:4 B. 3,1:3:12 C. 4, l:6:3:6 D. 2,1:3
难度: 中等查看答案及解析
-
有aL乙炔和乙烯的混合气体,在催化剂作用下与足量的H2发生加成反应,消耗H21.25aL,则乙烯与乙炔的体积比为 ( )
A.1∶1 B.2∶1 C.3∶1 D.4∶1
难度: 中等查看答案及解析
-
X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是( )
A. 晶格能: XCO3>YCO3 B. 阳离子半径: X2+>Y2+
C. 金属性: X>Y D. 氧化物的熔点: XO>YO
难度: 中等查看答案及解析
-
已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+离子位于八面体的中心。若其中两个NH3被Cl-取代,所形成的[Co(NH3)4Cl2] +同分异构体的种数为
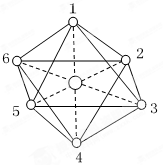
A.2 种 B.3 种 C.4 种 D.5种
难度: 中等查看答案及解析
-
断肠草(GelSemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科杭物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断不正确的是
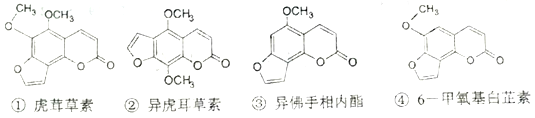
A. ①、②、③、④均能发生加成反应
B. ①与②、③与④分别互为同分异构体
C. ①、③互为同系物
D. 等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
难度: 困难查看答案及解析
-
下列有关实验操作的叙述和与实验得出的相应结论都正确的是
实验操作
结论
①
实验室用电石与饱和食盐水在启普发生器中制乙炔常会闻到臭味
乙炔是无色、略有臭味的气体
②
乙醇、浓硫酸混合加热170℃,导出的物质能使酸性高锰酸钾褪色
该反应生成了乙烯
③
在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银,会有沉淀析出
溴乙烷在碱性条件下能水解出Br-
④
提纯粗苯甲酸用重结晶法,主要步骤为:加热溶解、趁热过滤、冷却结晶、过滤、洗涤
苯甲酸在水中的溶解度受温度影响很大
⑤
苯不能与酸性高锰酸钾反应,而甲苯却能
苯环使甲基活化
A. ④⑤ B. ②④ C. ①②④ D. ③④⑤
难度: 困难查看答案及解析
-
下图是某药物中间体的结构示意图:
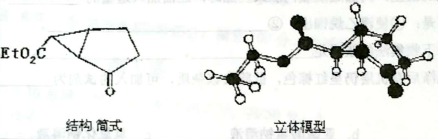
通过对比指出该药物中Et表示(写名称)_________。
难度: 中等查看答案及解析
-
从下列基团:-CH3、-OH、-COOH、-C6H6,相互两两组成的有机物有
A. 3个 B. 4个 C. 5个 D. 6个
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是
A. 氯化钾溶于水时离子键未被破坏 B. 原子晶体中共价键越强,熔点越高
C. 晶体中有阳离子必含阴离子 D. 分子间作用力越大,分子越稳定
难度: 中等查看答案及解析
-
制造氯乙烷的最好方法是
A. 乙烷氯代 B. 乙烯和氯气加成
C. 乙烯和氯化氢加成 D. 乙烯加氢后再氯代
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023/mol,下列说法一定正确的是
A. 60gSiO2晶体中,约含有2×6.02×1023个Si-O键
B. 78gNa2O2晶体中约有2×6.02×1023个阴离子
C. 720g C60晶体约含有6.02×1023个如图中晶胞单元

D. 14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目约为3×6.02×1023
难度: 困难查看答案及解析
-
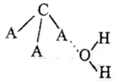
2004年6月美国科学家在银河星系中央的星云中发现了新的星际分子,该分子是由碳、氢、氧构成(如图)。星际分子的不断发现可帮助人们了解生命起源的过程。据图示该星际分子的说法不正确的是
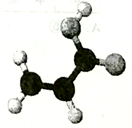
A. 该模型属于分子比例模型 B. 它的分子式为C3H4O2
C. 该分子含有两种官能团 D. 该物质能发生加成反应
难度: 困难查看答案及解析
-
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是
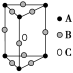
A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4
难度: 简单查看答案及解析
-
如右图所示为冰晶石(化学式为Na3AlF6)的晶胞。己知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF63- 。图中●位于大立方体顶点和面心,○位于大立方体的12 条棱的中点和8个小立方体的体心。则下列说法正确的是
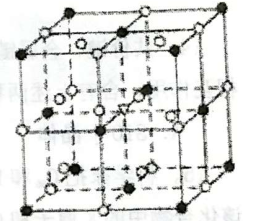
A. 冰晶石是原子晶体 B. 该物质中存在配位键
C. 大立方体的体心处△代表的是Al3+ D. 该物质是电解冶炼铝的还原剂
难度: 困难查看答案及解析
-
参考以下表格的键能数据,比较下列两组物质的熔点高低
SiC______Si;SiCl4_______Si
化学键
Si-O
Si-Cl
H-H
H-Cl
Si-Si
Si-C
键能(kJ/mol)
460
360
436
431
176
347
A. > > B. < < C. > < D. < >
难度: 中等查看答案及解析
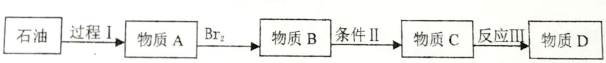
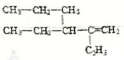 请用系统命名法对其命名_________。
请用系统命名法对其命名_________。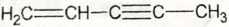 是环戊二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有______个;
是环戊二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有______个;
 (b)
(b) 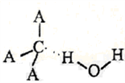
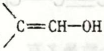 结构不稳定)的数目有___个(不考虑立体异构)。
结构不稳定)的数目有___个(不考虑立体异构)。