-
2018年世界环境日主题是“塑战速决”,呼吁世界各国齐心协力对抗一次性塑料污染问题。下列关于塑料的认识不正确的是
A. 用于制造水杯、奶瓶等的聚乙烯可通过乙烯的加聚反应制得
B. 用于制造玩具、泡沫塑料的聚苯乙烯的单体是苯乙烯
C. 聚氯乙烯在建筑材料、人造革、管材、食品包装膜等方面均有广泛应用
D. 开发可降解塑料来替代聚乙烯、聚氯乙烯、聚苯乙烯等可减缓“白色污染”
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 乙烯的比例模型:
B. S2-的结构示意图:
C. KCl的电子式:
D. 丙烯的结构简式:CH3CH=CH2
难度: 简单查看答案及解析
-
下列含有共价键的离子化合物是
A. Al2O3 B. NH3·H2O C. CH3COONa D. Na2O
难度: 简单查看答案及解析
-
下列属于物理变化的是
A. 煤的液化 B. 石油的分馏 C. 苯的硝化 D. 煤的干馏
难度: 简单查看答案及解析
-
下列物质的性质与用途的对应关系不正确的是
A. 甲烷燃烧放出大量的热,可用作燃料
B. 乙醇是一种常见的有机溶剂,可用于提取花瓣中的植物色素
C. 淀粉一定条件下发生水解反应,可用于工业上制取葡萄糖
D. 蛋白质溶液加入浓Na2SO4溶液后溶解度降低,可为人体提供能量
难度: 简单查看答案及解析
-
只用一种试剂就能鉴别醋酸溶液、葡萄糖溶液和淀粉溶液,这种试剂是
A. Cu(OH)2悬浊液 B. Na2CO3溶液 C. 碘水 D. NaOH溶液
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A. 苯的硝化反应的化学方程式:
+HO-NO2
+H2O
B. 电解饱和氯化铜溶液(惰性电极)的阳极反应式:Cu2++2e-=Cu
C. 打磨过的镁条与热水反应的离子反应式: Mg+2H+=Mg2++H2↑
D. 燃煤烟气用氨水法脱硫的化学反应式: 4NH3·H20+2SO2+O2=2(NH4)2SO4+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 12C和14C互为同素异形体
B. 金刚石和C60互为同位素
C. CH3-CH2-CH2-CH3和
互为同分异构体
D. C2H2和C6H6互为同系物
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A. 苯分子中含有碳碳双键,能与氢气发生加成反应
B. 乙烯分子中的所有原子共平面
C. 糖类、油脂和蛋白质均能发生水解反应
D. 乙醇和乙酸均能使石蕊试液变红
难度: 简单查看答案及解析
-
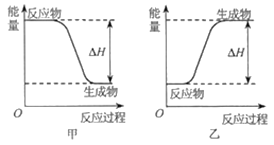
下列反应中热量变化与下图一致的是
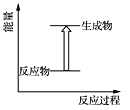
A. CO和O2反应 B. Na和H2O反应
C. NaOH溶液和HNO3溶液反应 D. NH4Cl晶体和Ba(OH)2·8H2O晶体反应
难度: 简单查看答案及解析
-
下图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是
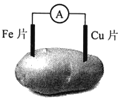
A. Fe作负极,电极反应式为: Fe-3e-=Fe3+ B. Cu作正极,Cu片质量减少
C. 电子由Fe经导线流向Cu片 D. 实现了电能向化学能的转化
难度: 中等查看答案及解析
-
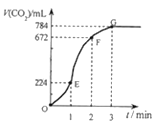
向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2
2SO3。下列说法不正确的是
A. 升高温度或充入一定量O2均能加快化学反应速率
B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2
C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态
D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
难度: 困难查看答案及解析