-
下列关于铜电极的叙述中正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气难度: 中等查看答案及解析
-
已知反应mX(g)+nY(g)⇌qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m难度: 中等查看答案及解析
-
铁-镍蓄电池放电和充电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2关于此蓄电池的下列说法中不正确的是( )
A.放电时铁为负极
B.充电时阴极的电极反应式为:Ni(OH)2-2e-=NiO2+2H+
C.放电时NiO2的反应为:NiO2+2H2O+2e-=Ni(OH)2+2OH-
D.蓄电池的电极必须浸在碱性电解质溶液中难度: 中等查看答案及解析
-
将2mol SO2,1mol O2 充入带活塞的密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是( )
A.保持温度和容器的压强不变,充入1mol SO3(g)
B.保持温度和容器的容积不变,充入1mol SO3(g)
C.保持温度和容器的压强不变,充入1mol O2(g)
D.保持温度和容器的压强不变,充入1mol Ar难度: 中等查看答案及解析
-
某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A.2种
B.3种
C.4种
D.5种难度: 中等查看答案及解析
-
已知N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1mol NH3.现在相同条件下的同一容器中充入xmol N2,ymol H2和2mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2kJ.则x、y的值为( )
A.1.5,6.5
B.2,8
C.5,21
D.3,13难度: 中等查看答案及解析
-
如图所示,表示反应2SO2(g)+O2
2SO3(g),△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )

A.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B.t1降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动难度: 中等查看答案及解析
-
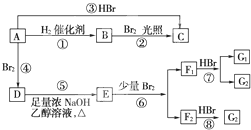
浓度为2mol•L-1的氢溴酸溶液VL,欲使其浓度变为4mol•L-1,以下列出的方法中,可行的为( )
A.通入标况下的HBr气体44.8L
B.加入10 mol•L-1氢溴酸0.6VL,再将溶液稀释至2VL
C.蒸发掉0.5L水
D.将溶液加热蒸发浓缩至0.5V难度: 中等查看答案及解析
-
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)难度: 中等查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1)
下列说法正确的是( )容器 甲 乙 丙 反应物投入量 1mol N2、3mol H2 2mol NH3 4mol NH3 NH3的浓度 c1 c2 c3 反应的能量变化 放出akJ 吸收bkJ 吸收ckJ 体系压强(Pa) p1 p2 p3 反应物转化率 α1 α2 α3
A.2c1>c3
B.a+b=92.4
C.2p2<p3
D.α1+α3<1难度: 中等查看答案及解析
-
某有机化合物A的相对分子质量大于100,小于130.经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为( )
A.1
B.2
C.3
D.4难度: 中等查看答案及解析
-
一些烷烃的燃烧热如下表:
下列表达正确的是( )化合物 燃烧热/kJ•mol-1 化合物 燃烧热/kJ•mol-1 甲烷 891.0 正丁烷 2 878.0 乙烷 1 560.8 异丁烷 2 869.6 丙烷 2 221.5 2-甲基丁烷 3 531.3
A.正戊烷的燃烧热小于3 531.3 kJ•mol-1
B.稳定性:正丁烷<异丁烷
C.乙烷的燃烧热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ•mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多难度: 中等查看答案及解析
-
H2A为二元弱酸,则下列说法正确的是( )
A.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
B.在等物质的量浓度的Na2A、NaHA两溶液中,前者pH大于后者
C.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
D.在Na2A溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)难度: 中等查看答案及解析
-
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4难度: 中等查看答案及解析
-
如图所示为对10mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的( )
A B C D X(mol/L) 0.12 0.04 0.03 0.09 Y(mol/L) 0.04 0.12 0.09 0.03 
A.选项A
B.选项B
C.选项C
D.选项D难度: 中等查看答案及解析
-
已知一些银盐的颜色及溶解度数值如下:
测定水体中氯化物的含量,常用标准硝酸银法进行滴定.滴定时,应加入的指示剂是( )化学式 AgCl AgBr AgI Ag2S Ag2CrO4 颜色 白色 浅黄色 黄色 黑色 红色 溶解度/g 1.5×10-4 7.1×10-7 2.1×10-7 1.3×10-16 4.3×10-2
A.KBr
B.KI
C.K2S
D.K2CrO4难度: 中等查看答案及解析
-
分子组成为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
A.该有机物不能发生加成反应,但能发生取代反应
B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C.该有机物分子中的所有原子可能在同一平面上
D.该有机物一种同分异构体的一溴代物可能有6种难度: 中等查看答案及解析
-
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极难度: 中等查看答案及解析