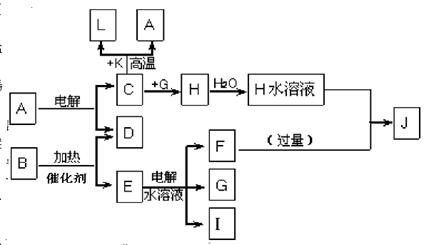
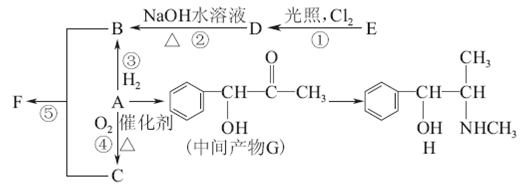
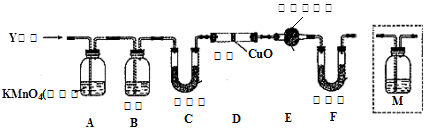
-
下列物质的分类结果全部正确的是 ( )
A.焦炉气—混合物 胆矾—纯净物 臭氧—单质
B.纯碱—碱 硫化氢—酸 小苏打—酸式盐
C.油脂—高分子化合物 纤维素—天然高分子化合物 有机玻璃—合成高分子化合物
D.液氯—非电解质 硫酸钡—强电解质 醋酸—弱电解质
难度: 简单查看答案及解析
-
下列事实与胶体性质无关的是 ( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
难度: 简单查看答案及解析
-
下列物质必须保存在棕色试剂瓶中的是 ( )
①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴水
A.全部 B.①③⑤ C.①③ D.①②④
难度: 简单查看答案及解析
-
下列有关物质性质的比较中,正确的是 ( )
①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为 ( )
A.只有AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
难度: 简单查看答案及解析
-
在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积占25% ,若反应前后条件保持不变,则反应后缩小的气体体积与原反应物的总体积的比值是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,3.2 g O3所含电子数为1.6NA
B.标准状况下,2.24 L CCl4中含有的C—Cl键的数目为0.4 NA
C.标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为2NA
D.将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+
难度: 简单查看答案及解析
-
下列有关离子方程式与所述事实相符且正确的是( )
A.用惰性电极电解CuCl2溶液:2Cu2++2H2O
4H++O2↑+2Cu
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO
===BaSO4↓+2H2O
C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水) ===Fe(OH)3(胶体)+3H+
D.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO
难度: 简单查看答案及解析
-
已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+
CO(g)===
Fe3O4(s)+
CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
难度: 简单查看答案及解析
-
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物
测定生成气体的体积
方案Ⅱ:铜铝混合物
测定剩余固体的质量
下列有关判断中正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,则测得铜的质量分数偏大
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
难度: 简单查看答案及解析
-
常温下,下列各组离子在所给条件下能够大量共存的是( )
A.酸性环境下的无色透明溶液中:Na+、Cu2+、NO
、SO
B.c(H+)=10-14mol·L-1的溶液中:Na+、AlO
、S2-、SO
C.能与金属铝反应放出氢气的溶液:Fe2+、SO
、NO
、Na+
D.使pH试纸显红色的溶液中:Cu2+、Fe3+、NO
、SO
难度: 简单查看答案及解析
-
下列关于有机化合物的认识正确的是( )
A.天然油脂是高分子化合物,同时也是混合物
B.淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体
C.氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性
D.糖类、油脂、蛋白质均能发生水解
难度: 简单查看答案及解析
-
HPE是合成除草剂的重要中间体,其结构简式如下图所示。下列有关HPE的说法不正确的是 ( )
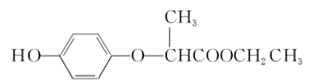
A.含1 mol HPE的溶液最多可以和2 mol NaOH反应
B.HPE能跟浓溴水反应产生白色沉淀
C.该化合物在核磁共振氢谱上显示有5组特征峰
D.该物质为芳香族化合物,分子式为C11H12O4
难度: 简单查看答案及解析