-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,下列说法中正确的是( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应难度: 中等查看答案及解析
-
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应力向移动
C.滴加少量0.1mol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向正反应方向移动难度: 中等查看答案及解析
-
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH.下列说法不正确的是( )
A.浓度均为0.1mol•L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1mol•L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变大难度: 中等查看答案及解析
-
下列物质中,属于弱电解质的是( )
A.CO2
B.HClO
C.BaSO4
D.CH3COONH4难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学反应不一定伴随着能量的变化
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行难度: 中等查看答案及解析
-
下列化学用语错误的是( )
A.氢硫酸的电离方程式:H2S⇌2H++S2-
B.明矾水解的离子方程式:Al3++3H2O⇌Al(OH)3+3H+
C.钢铁腐蚀时可能发生的正极电极反应式:2H2O+O2+4e-=4OH-
D.稀溶液中强酸与强碱反应的中和热:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1难度: 中等查看答案及解析
-
下列事实不能用原电池原理解释的是( )
A.镀锌铁比镀锡铁更耐用
B.铝片不用特殊方法保存
C.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
D.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快难度: 中等查看答案及解析
-
下列生产、生活等实际应用中,不能用勒夏特列原理解释的是( )
A.热的纯碱溶液去油污效果好
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是( )
A.化学反应速率v
B.水的离子积常数Kw
C.化学平衡常数K
D.醋酸的电离平衡常数Ka难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后溶液颜色变深的是( )
A.明矾溶液加热
B.小苏打溶液中加入少量NaCl固体
C.氨水中加入少量NH4Cl固体
D.CH3COONa溶液加热难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ•mol-1
B.+44.2 kJ•mol-1
C.-330 kJ•mol-1
D.+330 kJ•mol-1难度: 中等查看答案及解析
-
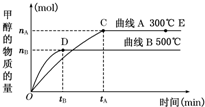
如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列正确的是( )

A.盐酸的物质的量浓度为1 mol/L
B.酚酞不能作本实验的指示剂
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.P点时反应恰好完全,溶液呈中性难度: 中等查看答案及解析
-
恒温恒压下,在容积可变的器皿中,反应2NO2(气)⇌N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
A.不变
B.增大
C.减小
D.无法判断难度: 中等查看答案及解析
-
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
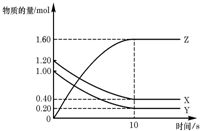
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动
C.T℃时,该反应的化学方程式为:X(g)+Y(g)⇌2Z(g),平衡常数K=40
D.向该密闭容器中充入少量稀有气体(不参加反应),平衡不移动难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.难溶电解质都是弱电解质
B.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
C.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
D.在白色ZnS沉淀上滴加CuSO4溶液,沉淀变黑色,说明CuS比ZnS更难溶于水难度: 中等查看答案及解析
-
在一密闭容器中,反应mA(g)+nB(g)⇌pC(g),达到平衡时,测得c(A)为0.5mol/L;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol/L.则下列判断正确的是( )
A.化学计量数:m+n>p
B.平衡向正反应方向移动
C.物质B的转化率增大
D.物质C的质量分数增加难度: 中等查看答案及解析
-
如图为一原电池装置,下列叙述中正确的是( )
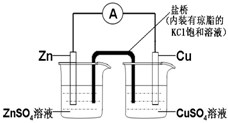
A.铜是阳极,铜片上有气泡产生
B.盐桥中的K+移向ZnSO4溶液
C.电流从锌片经导线流向铜片
D.铜离子在铜片表面被还原难度: 中等查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是( )
A.pH=6的纯水:c(OH-)<c(H+)
B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)>c(Na+)
C.0.1 mol/L的硫酸铵溶液中:c(NH)>c(SO
)>c(H+)
D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)难度: 中等查看答案及解析
-
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
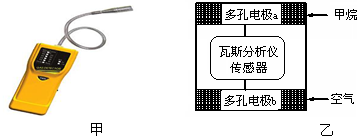
下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol难度: 中等查看答案及解析
-
根据下列实验现象,所得结论不正确的是( )
实 验 实验现象 结 论 A 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 活动性:Al>Fe>Cu B 左边棉花变为橙色,右边棉花变为蓝色 氧化性:Cl2>Br2>I2 C 白色固体先变为淡黄色,后变为黑色 溶度积:AgCl>AgBr>Ag2S D 锥形瓶中有气体产生,烧杯中液体变浑浊 酸性:HCl>H2CO3>H2SiO3
A.
B.
C.
D.
难度: 中等查看答案及解析