-
下列用品的主要成分及其用途对应不正确的是( )
A
B
C
D
用品




主要成分
H2O2
Na2CO3
Al(OH)3
NaCl
用途
消毒剂
发酵粉
抗酸药
调味品
难度: 简单查看答案及解析
-
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
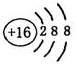
A.硫的原子结构示意图:
B.NH4Br的电子式:

C.中子数为20的氩原子:
Ar
D.Be2+中的质子数和电子数之比为:2∶1
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A. 雾是气溶胶,在阳光下可观察到丁达尔效应
B. 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀
C. 用石膏或卤水点制豆腐利用了胶体的性质
D. 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.不同原子构成的物质可能是单质、化合物或混合物
B.酸性氧化物一定是非金属氧化物
C.电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化
D.化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成
难度: 中等查看答案及解析
-
月球表面土壤里有一种非常有用的资源——3He,它是可控核聚变的原料,关于3He的叙述正确的是( )
A. 3He和4He是同种原子
B. 3He和4He互为同位素
C. 核聚变时,原子核发生了变化,发生了化学变化
D. 在3He中存在:质子数=中子数=核外电子数
难度: 中等查看答案及解析
-
铝在人体内积累可是人慢性中毒,1989年世界卫生组织正式将铝定为“食品污染源之一”而加以控制。 铝在下列使用场合须加以控制的是( )
① 糖果包装 ② 电线电缆 ③ 牙膏皮 ④ 氢氧化铝胶囊(作内服药) ⑤ 用明矾净水 ⑥ 用明矾和小苏打混合物作食品膨化剂 ⑦ 制造炊具和餐具 ⑧ 制防锈漆
A. ①③④⑤⑥⑦ B. ②③④⑤⑥
C. ②③⑤⑦⑧ D. 全部
难度: 简单查看答案及解析
-
将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是( )
选项
实验现象
结论
A
方形金属钠变成小球
方形钠反应速率快
B
钠浮于水面
水的密度大于钠
C
酚酞溶液变成红色
有NaOH生成
D
钠球游动,有吱吱声
有气体产生
难度: 简单查看答案及解析
-
下列各组物项相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
① 金属钠投入FeCl2溶液中
② 过量的NaOH溶液和明矾溶液反应
③ 少量CaO投入过量的NaHCO3溶液中
④ Na2O2投入到CuSO4溶液中
A. ①③ B. ③④ C. ①④ D. ②③
难度: 简单查看答案及解析
-
① 是配制一定物质的量的浓度的溶液的专用仪器
② 使用前要先检查容里量瓶走否漏液
③ 容量瓶可以用来加热
④ 不能用容量瓶贮存配制好的溶液
⑤ 用500 mL容量瓶配制250 mL溶液
A. ①和② B. ①②④⑤ C. 除了③ D. 除了③⑤
难度: 简单查看答案及解析
-
下列变化不属于化学变化的是( )
① 皂化反应
② 给装有氯化铵的试管加热,在管口又有白色晶体产生
③ 太阳光照在装有氯水的瓶子上,瓶子里有气泡产生
④ 碘受热有紫色蒸气产生
⑤ 碳酸钠晶体的风化
⑥ 向皂化后的溶液中加入氯化钠粉末使肥皂析出
⑦ 铁、铝常温遇浓硫酸发生钝化
⑧ 二氧化氮气体遇冷颜色变浅
A.①⑤⑥ B. ④⑥ C.②④⑦ D.③④⑧
难度: 简单查看答案及解析
-
把0.1 mol KOH固体分别加入到下列100 mL的液体中,溶液的导电能力无变化的是( )
A.纯净水 B.0.l mol/L HCl
C.1.0 mol/L CH3COOH D.0.5 mol/L H2SO4
难度: 简单查看答案及解析
-
下列氧化还原反应中电子转移数目及方向都正确的是( )
A.
 B.
B. 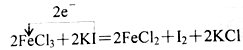
C.
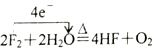 D.
D. 
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是( )
选项
操作
现象
解释或结论
A
Fe(OH )3 胶体通电后
阴极区红褐色加深
Fe(OH)3胶体带正电
B
Al箔插入稀HNO3中
无现象
Al箔表面被稀HNO3 氧化,形成致密的氧化膜
C
将过量的过氧化钠投入
滴有酚酞试液的水中
最终得红色溶液
过氧化钠与水反应生成碱性物质
D
将镁粉和铝粉的混合物加
入过量的烧碱溶液中
仍有未溶解粉末
铝粉能与烧碱溶液反应,而镁粉不反应
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段。下列分类结论正确的是( )
① 氨水、氢氧化铝、冰醋酸、氟化氢都是弱电解质
② HClO、浓硫酸、HNO3均具有强氧化性,都是氧化性酸
③ Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
④ HI、CH3COOH、胆矾、氯气都是电解质
⑤ NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物
⑥ 漂粉精、福尔马林、水玻璃、水银都是混合物
⑦ 青铜、硬铝、不锈钢和目前流通的硬币都是合金
⑧ C60、C70、金刚石、石墨都是碳的同素异形体
A.①②③④ B.②⑤⑥⑧ C.②⑦⑧ D.③⑤⑥⑦
难度: 简单查看答案及解析
-
已知阿伏加德罗常数的值为NA,下列说法正确的是( )
① 标准状况下,22.4 L CHCl3中含有的氧原子数目为3 NA
② 14 g乙烯和丙烯的混合物中总原子数为3 NA
③ 0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA
④ 1 mol NaHSO4晶体中含有的离子总数为3 NA
⑤ 标准状况下,NO和O2 各11.2 L混合,所得混合气体的分子总数为0.75 NA
⑥ 1 L 1 mol/L FeCl3完全水解生成NA个胶体粒子
⑦ 101 kPa、4℃时18 mL水和202 kPa、27℃时32 g O2所含分子数均为NA
⑧ 常温常压下,4.9 L的CO、O2、CO2混合气体含分子数共0.2 NA
A.只有①③⑦ B.除①⑧外 C.除⑥外 D.只有②⑦⑧
难度: 简单查看答案及解析
-
下列物质均为Wg,将它们在氧气中完全燃烧的产物全部通入到过量的过氧化钠固体中,则过氧化钠固体增重为Wg的是( )
① CO ② H2 ③ CH4 ④ HCHO ⑤ CH3COOH ⑥ HCOOH
A.①②⑥ B.③④⑤ C.①②④⑤ D.②③⑤
难度: 困难查看答案及解析
-
下列实验现象及相关的离子方程式均正确的是( )
A.碳酸钙粉末中加入醋酸溶液,固体逐渐减少,生成无色气体:
CaCO3 + 2 H+ = Ca2+ + CO2↑ + H2O
B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2 H+
C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色
2 MnO4- + 7 H2O2 + 6 H+ = 2 Mn2+ + 6 O2↑ + 10 H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀:
Ba2+ + SO42- + H+ + OH-= BaSO4↓ + H2O
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
① 无色溶液中:K+、Na+、Cu2+、SO42-
② pH=14的溶液中:CO32-、Na+、AlO2-、NO3-
③ 加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、Na+
④ 含有大量NH4+的溶液中:Ba2+、K+、Cl-、H+
⑤ 能使甲基橙变红的溶液:Na+、Cl-、K+、SiO32-
⑥ 强酸性溶液中:Fe2+、Al3+、NO3-、Cl-、
A.②⑤ B.②④⑥ C.②④ D.③⑤⑥
难度: 简单查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A. 常压下五种元索的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
难度: 简单查看答案及解析
-
已知反应:①Cl2+2KBr=2KCl+Br2
②KClO3+6HCl=3Cl2+KCl+3H2O
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是()
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱的顺序为:KBrO3 > KClO3 > Cl2 > Br2
C.反应②中还原剂与氧化剂的物质的量之比为6∶1
D.③中1 mol Cl2反应则氧化剂得电子的物质的量为2 mol
难度: 中等查看答案及解析
-
某无色溶液,只可能含有以下离子中的若干种(忽略水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+、NO3一、CO32一、SO42-,现取三份100 mL溶液进行如下实验:
① 第一份加足量AgNO3溶液后,有白色沉淀产生;
② 第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为4.66 g;
③ 第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如下图。
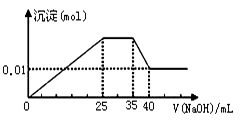
根据上述实验,以下推测不正确的是( )
A.依据电荷守恒,原溶液中NO3-的物质的量应为0.03 mol
B.原溶液一定不存在H+、Fe3+、CO32-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n( NH4+) = 1∶1∶2
D.实验所加的NaOH的浓度为2 mol·L-1
难度: 困难查看答案及解析