-
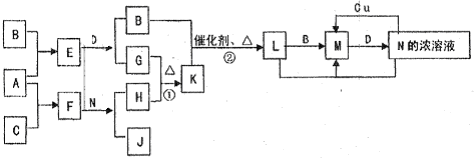
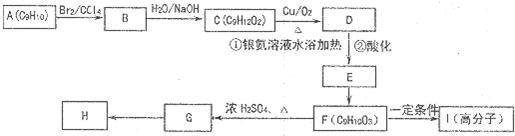
A、B、C三种短周期元素在元素周期表中的位置如图所示,已知A、C元素可分别与B元素形成化合物X和Y,A与B的质子数之和等于C的质子数.现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体A B C
②X的种类比Y的多
③沸点:A的最简单氢化物低于C的最简单氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐.
A.①②③④
B.②③
C.①②④
D.①④难度: 中等查看答案及解析
-
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘131和铯137(55137Cs)向外界泄漏.下列相关说法错误的是( )
A.每个55137Cs原子中有82个中子
B.CsOH的碱性比KOH强
C.KIO3是碘的最高价氧化物的水化物的盐
D.I¯比F¯还原性强难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是( )
A.H2O2的电子式:
B.O2-的结构示意图:
C.聚氯乙烯的结构简式:
D.丙烷分子的球棍模型示意图: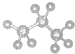
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.1mol乙醇与足量钠反应生成H2的分子数目为3NA
B.0.1molFe参加氧化还原反应,转移的电子数目一定是0.2NA
C.CO和N2互为等电子体,22.4L的CO气体与NA个N2所含的电子数相等
D.在一定条件下,13.0g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.用Na2CO3溶液作洗涤剂:CO32-+2H2OH2CO3+2OH-
C.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
D.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO-3+5I-+3H2O=3I2+6OH-难度: 中等查看答案及解析
-
下列说法错误的是( )
A.分子式为C3H6Cl2的有机物有四种
B.医疗上用硫酸钡作“钡餐”,是由于硫酸钡难溶于水
C.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
D.相同物质的量的2-甲基丁烷和2,2-二甲基丙烷中共用电子对数目相同难度: 中等查看答案及解析
-
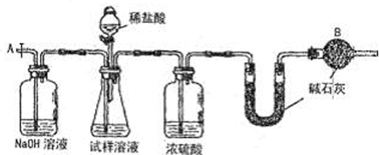
利用下列实验装置能完成相应实验的是( )
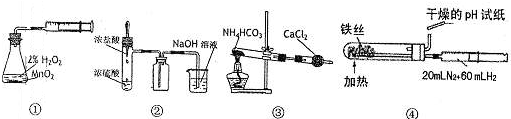
A.装置①测定化学反应速率
B.装置②制取并吸收HCl
C.装置③制备纯净干燥的NH3
D.装置④合成氨并检验氨的生成难度: 中等查看答案及解析