-
(I)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)═2SO3(g);△H=-196kJ•mol-1.2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ.请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为______;该条件下反应的平衡常数K=______(精确到小数点后两位)
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
(4)上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
①再通入1.6molSO2、0.8molO2、0.4molSO3,______;
②再通入0.2molSO2、0.2molSO3,______.
(II)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
已知:
2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g).△H=2a kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4KJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则a=______.难度: 中等查看答案及解析
-
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大.A、E同主族,A元素原于半径是周期表中所有元素中最小的,B元素原子的最外层电子数是内层电子数的2倍.C元素最高价氧化物的水化物X能与其氢化物Y反应生成盐,F是地壳中含量最多的金属元素.A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.
(1)写出Y和D2在催化剂作用下反应的化学方程式______△4NO+6H2O难度: 中等查看答案及解析
-
(1)某研究性学习小组利用所学知识进行下列实验研究.如图I所示(导管出口高于液而)请回答下列问题:
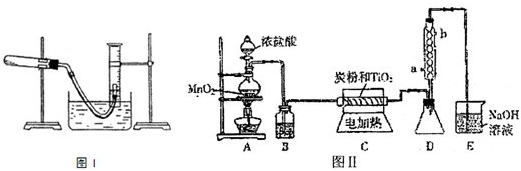
①测量收集到气体的体积必须包括的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积.这三步操作的正确顺序是:______(请填写步骤代号).
②测量收集到气体体积时,如何使量筒内外液面的高度相同?______.
(2)在图I中利用高锰酸钾分解制氧气,为了得到二氧化锰,实验完毕将图I中的试管冷却后,把剩余的药品倒入烧杯中加水溶解,再经过滤、洗涤和干燥得到纯净的二氧化锰.“过滤”装置中使用的玻璃仪器除烧杯外还有______.
(3)图II是实验室制取TiCl4的装置.四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中的水蒸汽即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl).在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和CO气体.
①A装置中反应的离子方程式______ Mn2++Cl2↑+2H2O难度: 中等查看答案及解析
-
1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献.Grignard试剂的合成方法是:RX+Mg
RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
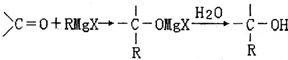
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性.合成线路如下: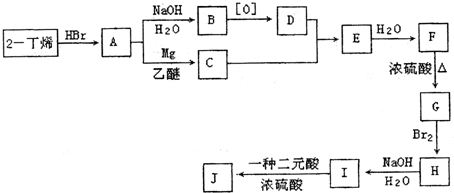
请按要求填空:
(1)3,4-二甲基-3-己醇是:______(填字母代号),G的结构简式是______;
(2)H→I的反应类型是______,F→G的反应类型是______;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B______;
I→J______.难度: 中等查看答案及解析